Aurine
| Aurine | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van aurine
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | 4-[bis-(4-hydroxyfenyl)-methyl]-cyclohexa-2,5-dienon | |||
| Andere namen | p-rosolzuur, coralline | |||
| Molmassa | 290,313 g/mol | |||
| SMILES | C1=CC(=O)C=CC1=C(C2=CC=C(C=C2)O)C3=CC=C(C=C3)O
| |||
| CAS-nummer | 603-45-2 | |||
| Wikidata | Q423995 | |||
| Beschrijving | Rood tot oranje kristallijne vaste stof | |||
| Vergelijkbaar met | trifenylmethanol | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H315 - H319 - H335 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P261 - P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,283 g/cm³ | |||
| Smeltpunt | (ontleedt) 308 °C | |||
| Goed oplosbaar in | aceton, ethanol, di-ethylether | |||
| Slecht oplosbaar in | water | |||
| Analytische methoden | ||||
| Klassieke analyse | spectrofotometrie | |||
| Spectra | maximale absorptiepiek bij λ = 482 nm | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Aurine is een organische verbinding die valt onder de klasse van triarylmethaankleurstoffen. De zuivere stof vormt rode tot oranje kristallen, die slecht oplossen in water.
Synthese[bewerken | brontekst bewerken]
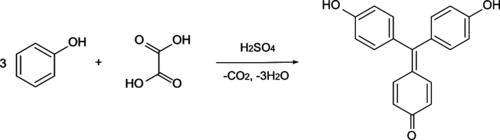
Aurine kan bereid worden door fenol, oxaalzuur en enkele druppels zwavelzuur te verhitten:
Onder invloed van zwavelzuur ontstaat koolstofdioxide, dat vervolgens met het fenol reageert. Fenol wordt waarschijnlijk gekoppeld middels een elektrofiele aromatische substitutie.
Structuur en eigenschappen[bewerken | brontekst bewerken]
Een sterk verdunde oplossing ervan in water kleurt in neutraal en zuur milieu sterk geel. Een basische oplossing is donkerrood-roze gekleurd. Het kleurverschil wordt veroorzaakt doordat in een basisch milieu de fenolische groepen worden gedeprotoneerd tot fenolische anionen, waardoor de lichtbreking sterk verandert. De negatieve lading van de gedeprotoneerde fenolgroepen raakt gedelokaliseerd in het aromatische systeem, hetgeen een verschil in absorbantie van zichtbaar licht tot gevolg heeft. In een zeer zuur milieu vindt er ook structuurverandering plaats, de keton groep raakt geprotoneerd en gaat over in zijn enolvorm. Hierdoor wordt ook de derde ring aromatisch, maar wordt het centrale koolstofatoom positief geladen.
Aurine vertoont een maximale absorbantie bij een golflengte van 482 nm.
Toepassingen[bewerken | brontekst bewerken]
Door het gedrag van de stof bij verschillende zuurtegraden, kan aurine aangewend worden als pH-indicator. De kleuromslag grijpt plaats in het gebied tussen pH 5,0 en 6,8.
Het natriumzout van aurine wordt gebruikt als kleurstof voor papier en tapijten.
Externe link[bewerken | brontekst bewerken]
- (en) MSDS van aurine