Chiraliteit (scheikunde)

Chiraliteit is asymmetrie in de stereochemie. Een stof met een chiraal centrum of een halfregelmatig veelvlak met meerdere chirale vormen is dus niet symmetrisch. In de kristallografie wordt hiervoor de term enantiomorfie gebruikt.
Stoffen met een chiraal centrum[bewerken | brontekst bewerken]
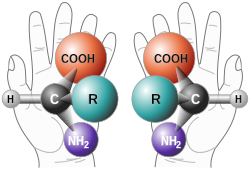
Van een stof met een chiraal centrum komen isomeren voor die andere chemische eigenschappen bezitten. Chirale verbindingen zijn niet superponeerbaar: dat wil zeggen dat hun spiegelbeelden niet op elkaar te passen zijn. Ditzelfde geldt voor enantiomorfe kristallen. Dit principe is afgeleid van onze handen: deze zijn elkaars spiegelbeeld, maar kunnen op geen enkele manier op elkaar gesuperponeerd worden. De term chiraliteit is afgeleid van het Griekse cheir, wat hand betekent.
Koolstofatoom[bewerken | brontekst bewerken]
Een chiraal koolstofatoom heeft vier verschillende substituenten. Het koolstofatoom in kwestie dient daarbij dus sp3-gehybridiseerd te zijn. Een dubbele binding wordt als één binding gezien.
Tekenen van chirale verbindingen[bewerken | brontekst bewerken]
In de onderste van de twee tekeningen hiernaast wordt in de manier waarop de bindingen tussen de verschillende atomen getekend zijn, aangegeven hoe deze bindingen verlopen:
- gewoon getrokken streep
- de binding ligt in het vlak van de tekening (beeldscherm).
- Vanaf het koolstofatoom naar de substituent breder wordende lijn
- De binding komt vanaf het koolstof-atoom naar de kijker toe. De binding komt vanaf het koolstof-atoom steeds verder voor het vlak van de tekening te liggen. De substituent is dichterbij dan het koolstof-atoom.
- Stippelstreep tussen koolstof en de substituent
- De binding gaat vanaf het koolstof-atoom steeds verder bij de kijker vandaan en ligt steeds verder achter het vlak van de tekening. De substituent aan deze binding is verder bij de kijker vandaan dan het koolstofatoom.
Structuur[bewerken | brontekst bewerken]
De chiraliteit kan ook ontstaan door de structuur van de verbinding. Als voorbeeld kunnen hier verbindingen van het type bifenyl genomen worden: twee ringen die in principe ten opzichte van elkaar kunnen draaien. Als er alleen waterstofatomen aan de fenylringen zitten is dat ook waar. Worden de waterstofatomen op de 2-, 2'- en de 5-positie vervangen dan kan een chirale verbinding ontstaan. In het geval van 2,2'-dibroom-5-jood-bifenyl kan het broomatoom op de 2'-plaats niet langs de substituenten op de 2- en de 5-plaats draaien. Er is een chirale verbinding ontstaan. In het geval van de bifenylen spreekt men dan van axiale chiraliteit.
Halfregelmatige veelvlakken met chirale vormen[bewerken | brontekst bewerken]
Een halfregelmatig veelvlak met meerdere chirale vormen heeft verschillende varianten die elkaars spiegelbeeld zijn.
