Dewarbenzeen
| Dewarbenzeen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van dewarbenzeen
| ||||
| Algemeen | ||||
| Molecuulformule | C6H6 | |||
| IUPAC-naam | bicyclo[2.2.0]hexa-2,5-dieen | |||
| Molmassa | 78,11184 g/mol | |||
| SMILES | C1=CC2C1C=C2
| |||
| InChI | 1S/C6H6/c1-2-6-4-3-5(1)6/h1-6H
| |||
| CAS-nummer | 5649-95-6 | |||
| PubChem | 98808 | |||
| Wikidata | Q425101 | |||
| ||||
Dewarbenzeen is een structuurisomeer van benzeen met een door James Dewar voorgestelde structuur. Hoewel Friedrich Kekulé pas later de nu als correct erkende structuur van benzeen voorstelde, is nadien wel een molecule met de door Dewar voorgestelde structuur gevonden. Dewarbenzeen is geen aromaat en derhalve veel minder stabiel dan benzeen. Omdat dewarbenzeen net als benzeen opgebouwd is uit 6 CH-groepen, die alleen op een andere manier aan elkaar zitten, wordt dewarbenzeen ook wel een valentie-isomeer van benzeen genoemd. De structuur van dewarbenzeen kan worden opgevat als twee cyclobuteenringen die via 1 binding gefuseerd zijn met elkaar.
Synthese[bewerken | brontekst bewerken]
Dewarbenzeen kan uit benzeen bereid worden door benzeen met UV-licht te bestralen. Het reactiemengsel moet gekoeld worden want bij temperatuurverhoging wordt dewarbenzeen weer omgezet in benzeen.
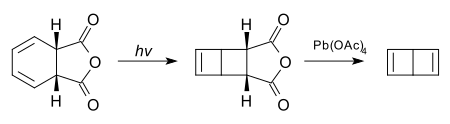
Een alternatieve methode is de fotolyse van cis-1,2-dihydroftaalzuuranhydride, gevolgd door oxidatie met lood(IV)acetaat:[1]
Stabilisatie[bewerken | brontekst bewerken]
Het introduceren van substituenten maakt de dewarbenzeenstructuur relatief stabieler. Deze stabilisatie heeft vooral sterische achtergronden. De benzeenring is in principe vlak. De zes koolstofatomen en de atomen die daar direct aan gebonden zijn liggen in één vlak. Dewarbenzeen is geen vlak molecuul: de vlakken van de twee cyclobuteenringen maken een hoek met elkaar en de substituenten aan de centrale koolstofatomen krijgen daardoor meer ruimte. Het hele molecuul lijkt meer op een zadel: de twee cyclobuteenringen vormen de zijden, de substituenten op de centrale koolstofatomen de zadelknop(pen). Ook de substituenten aan de andere koolstofatomen, hoewel nog steeds in één plat vlak met hun koolstofatomen, krijgen meer ruimte. Hier wordt de extra ruimte gewonnen, doordat de hoek tussen de ringkoolstofatomen kleiner is geworden waardoor de hoek van de substituenten met de bindingen van de ring groter kan worden. Als stabiliserende substituenten zijn methyl-, tert-butyl- en trifluormethylgroepen beschreven.
Bronnen, noten en/of referenties
|