Difenyldiselenide
| Difenyldiselenide | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||

| |||||
Structuurformule van difenyldiselenide
| |||||
| Algemeen | |||||
| Molecuulformule | C12H10Se2 | ||||
| IUPAC-naam | difenyldiselenide | ||||
| Molmassa | 312,13 g/mol | ||||
| SMILES | c1ccc(cc1)[Se][Se]c2ccccc2
| ||||
| InChI | 1/C12H10Se2/c1-3-7-11(8-4-1)13-14-12-9-5-2-6-10-12/h1-10H
| ||||
| CAS-nummer | 1666-13-3 | ||||
| PubChem | 15460 | ||||
| Wikidata | Q3538196 | ||||
| Beschrijving | Oranje poeder | ||||
| Vergelijkbaar met | benzeenselenol difenyldisulfide | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H301 - H331 - H373 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P261 - P273 - P301+P310 - P311 - P501 | ||||
| VN-nummer | 3283 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | oranje | ||||
| Dichtheid | 1,84 g/cm³ | ||||
| Smeltpunt | 59 - 61 °C | ||||
| Oplosbaarheid in water | niet g/L | ||||
| Goed oplosbaar in | dichloormethaan | ||||
| Geometrie en kristalstructuur | |||||
| Dipoolmoment | 0 D | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Difenyldiselenide is een organoseleenverbinding met als brutoformule C12H10Se2. De formule wordt vaak afgekort tot Ph2Se2. Deze oranje vaste stof is het eerste oxidatieproduct van benzeenselenol. In de organische synthese wordt de stof gebruikt als bron voor de fenylselenide-eenheid. De centrale Se-Se-binding heeft een lengte van 229 pm.[1]
Synthese[bewerken | brontekst bewerken]
Difenyldiselenide wordt bereid in een tweestapssynthese via oxidatie van het benzeenselenolaat, dat zelf bereid wordt uit fenylmagnesiumbromide:[2]
Reacties[bewerken | brontekst bewerken]
De reductie met natrium levert natriumfenylselenolaat:
Natriumfenylselenolaat is een goed bruikbaar nucleofiel: het elektropositieve natrium genereert een negatieve lading op seleen. De fenylselenylgroep kan via een nucleofiele substitutie van alkylhalogeniden, alkylsulfonaten, (mesylaten of tosylaten) of epoxiden in een organische verbinding gebracht worden. Onderstaand voorbeeld is ontleend aan de synthese van morfine.[3]
De reactie met dichloor levert fenylselenylchloride, een elektrofiel:
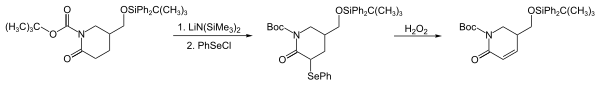
Door de reactie met een nucleofiel kan de fenylselenylgropep in een organische verbinding worden geïntroduceerd. Als nucleofielen kunnen enolaten, enolsilylethers, Grignard-reagentia, organolithiumverbindingen, alkenen en amines optreden. In het voorbeeld hieronder, de eerste stappen in de synthese van strychnofoline, wordt een fenylselenylgroep geïntroduceerd via het enolaat van een lactam:[4]
Deze methode is een belangrijk stuk organisch-synthetisch gereedschap voor de omzetting van carbonylverbindingen naar hun α,β-onverzadigde analoga.[5]
Met krachtige nucleofielen kan difenyldiselenide zelf als elektrofiel optreden, het nucleofiel is dan een Grignard- of organolithium-reagens of het enolaat van een ester. Enolaten van ketonen reageren niet. Meestal wordt de voorkeur gegeven aan fenylselenylchloride, omdat bij de reactie met difenyldiselenide de helft van het selenidereagens als leaving group optreedt, en dus eigenlijk verspild wordt:
N-fenylselenoftaalimide (N-PSP) kan gebruikt worden als fenylselenylchloride een te sterk elektrofiel is en anderzijds difenyldiselenide niet reactief genoeg of te duur is.[6]
Externe links[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|