Di-jood
| Di-jood | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
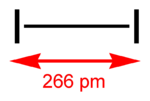
Structuurformule van di-jood
| ||||

| ||||
Di-joodkristallen
| ||||
| Algemeen | ||||
| Molecuulformule | I2 | |||
| IUPAC-naam | di-jood | |||
| Andere namen | moleculair jood | |||
| Molmassa | 253,80894 g/mol | |||
| SMILES | II
| |||
| InChI | 1/I2/c1-2
| |||
| CAS-nummer | 7553-56-2 | |||
| EG-nummer | 231-442-4 | |||
| PubChem | 807 | |||
| Wikidata | Q2064483 | |||
| Beschrijving | Donkergrijze tot donkerviolette vluchtige kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H312 - H332 - H400 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P273 - P280 | |||
| EG-Index-nummer | 053-001-00-3 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | donkergrijs-donkerpaars | |||
| Dichtheid | 4,933 g/cm³ | |||
| Smeltpunt | 113,70 °C | |||
| Kookpunt | 184,2 °C | |||
| Dampdruk | 41 Pa | |||
| Oplosbaarheid in water | 0,3 g/L | |||
| Goed oplosbaar in | chloroform, aceton | |||
| Matig oplosbaar in | ethanol, di-ethylether, tetrahydrofuraan | |||
| Slecht oplosbaar in | water | |||
| log(Pow) | 2,49 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Di-jood of moleculair jood (I2) is de belangrijkste enkelvoudige stof van het element jood. Bij normale druk en temperatuur is di-jood een kristallijne vaste stof met een donkergrijze tot donkerviolette kleur en een metaalglans. De vaste stof is vluchtig en sublimeert gemakkelijk tot een paarse damp met een prikkelende geur.
Eigenschappen en reacties[bewerken | brontekst bewerken]
Zoals andere halogenen kan di-jood met veel andere elementen verbindingen vormen. De reactiviteit is echter minder groot dan de lichtere halogenen zoals difluor en dichloor. Met diwaterstof reageert di-jood tot waterstofjodide:
Di-jood kan gereduceerd worden tot jodide, maar is in vergelijking met dichloor en difluor een matige oxidator (E° = 0,54 V). Di-jood wordt gereduceerd tot waterstofjodide door waterstofsulfide:[1]
Het kan ook door hydrazine gereduceerd worden:
Di-jood wordt geoxideerd tot waterstofjodaat door salpeterzuur:[2]
Ook met chloraten kan dit plaatsgrijpen:[2]
Di-jood wordt omgezet in twee stappen in jodide en jodaat in oplossingen van hydroxiden van alkalimetalen (zoals natriumhydroxide):[3]
Met ammoniak reageert di-jood tot het explosieve stikstoftri-jodide.
Di-jood lost vrij slecht op in water maar lost goed op in ethanol (joodtinctuur), chloroform, tetrachloormethaan en koolstofdisulfide en in een waterige oplossing van kaliumjodide (lugol-oplossing). Oplossingen van di-jood in zuurstofhoudende oplosmiddelen hebben een bruine kleur; oplossingen van de stof in andere oplosmiddelen een paarse of roze kleur. De oplosbaarheid van di-jood in water kan verhoogd worden door een hoeveelheid kaliumjodide toe te voegen. Hierbij wordt het goed oplosbare tri-jodide gevormd:
Di-jood reageert exotherm wanneer het in contact komt met alfa-pineen (een van de hoofdcomponenten van terpentijn). De reden hiervoor is dat alfa-pineen een dubbele binding in een gespannen ringsysteem bezit, waaraan di-jood kan adderen. Met deze additie gaat een omlegging van het koolstofskelet gepaard, hetgeen de exotherme reactie verklaart.
Synthese[bewerken | brontekst bewerken]
Di-jood kan bereid worden door oxidatie van jodiden met dichloor:
Een andere methode is de oxidatie met mangaan(IV)oxide in zuur milieu:[3]
Toepassingen[bewerken | brontekst bewerken]
In een mengsel van water en ethanol opgelost wordt di-jood gebruikt voor het ontsmetten van wonden en bij operaties (joodtinctuur). Een variant hiervan is povidonjood (betadine).
Wanneer een di-joodoplossing en een zetmeeloplossing (stijfsel) worden samengevoegd ontstaan er jood-zetmeelamylosecomplexen, die zich kenmerken door een diepblauwe kleur. Zodoende wordt di-jood gebruikt als indicator voor zetmeel, en omgekeerd.
Di-jood wordt gebruikt voor het doteren van halfgeleiders.[4]
Externe link[bewerken | brontekst bewerken]
| Bronnen, noten en/of referenties |












