Fenestraan
Een fenestraan is in de organische chemie een verbinding met een centraal quaternair koolstofatoom dat functioneert als het gezamenlijke hoekpunt van 4 gekoppelde ringsystemen.[1] Ze kunnen beschouwd worden als een dubbele spiroverbinding. Vooral bij de kleinere ringen zal dit leiden tot een grote mate van ringspanning en instabiliteit. Deze laatste factoren betekenen enerzijds dat de verbindingen weinig technisch en praktisch nut hebben, maar voor chemici zijn de eigenschappen wel interessant. De naam voor deze groep verbindingen is in 1972 voorgesteld door Vlasios Georgian en Martin Saltzman[2] en is afgeleid van het latijnse woord voor raam: fenestra.
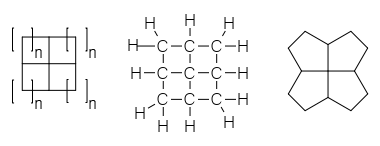
Het kleinste lid van deze familie bestaande uit 4 gekoppelde cyclopropaanringen is [3,3,3,3]fenestraan of pyramidaan, een molecule vergelijkbaar met tetrahedraan, ook zelf al opmerkelijk genoeg. In het volgende (regelmatige) lid van de familie zijn 4 cyclobutaanringen met elkaar versmolten, waardoor het vensterpatroon ontstaat waaraan de verbindingen hun naam danken. In de fenestraan-naamgeving wordt de stof [4,4,4,4]fenestraan genoemd: tel simpelweg de ringgroottes, zet de aantallen gescheiden door komma's tussen blokhaken voor "fenestraan" en je hebt de naam van de verbinding. De standaard naam volgens de IUPAC-regels is minder duidelijk: tetracyclo[3.3.1.03,9.07,9]nonaan.
In extreme gevallen (kleine ringen) zal het centrale koolstofatoom dat gewoonlijk een tetraëdrische structuur heeft geforceerd worden tot een volledig vlakke structuur. In het orbitalenplaatje van een koolstofatoom met vier substituenten in één plat vlak betekent het voor methaan dat twee van de 3 sp2 gehybridiseerde koolstof-orbitalen standaard bindingen naar 2 waterstofatomen vormen. De derde sp2-orbitaal doet mee in een drie-centra twee-elektronenbinding met de twee overgebleven waterstofatomen waarbij de waterstofatomen de elektronen leveren. De twee overgebleven valentie-elektronen van koolstof bezetten de niet gehybridiseerde p-orbitaal, loodrecht op het vlak van het molecule. De vier koolstof-waterstofbindingen zijn vanwege resonatie-structuren gelijk. In-silicoberekeningen tonen aan dat er 400 tot 1050 kJ/mol nodig is om vanuit standaard methaan in deze platte toestand te komen.
Een van de fenestranen met de hoogste ringspanning die ook daadwerkelijk geïsoleerd zijn is een [4,4,4,5]fenestraan waarbij de bindingshoeken rond het centrale koolstofatoom ongeveer 130° bedragen, gebaseerd op Röntgendiffractie. De bindingen rond het centrale koolstofatoom in dit molecule zijn iets korter, 149 picometer, dan de standaard waarde in bijvoorbeeld ethaan (155 pm), terwijl de bindingen aan de buitenzijde van het molecule opgerekt zijn tot 159 pm.
Het allereerste fenestraan dat ooit gemaakt is was een [4,5,5,6]fenestraan:[2]

Het enige bekende fenestraan dat in de natuur voorkomt is laureneen.
Onderzoek (2006 - 2009)[bewerken | brontekst bewerken]
Een studie uit 2006-2009 beschreef de synthese van een [4,5,5,5]fenestraan waarin een koolstofatoom was vervangen door een stikstofatoom. Aza-verbindingen vormen makkelijker kristallijne zouten de geschikt zijn voor röntgendiffractie.[3] In onderstaande figuur is de reactieroute weergegeven die uiteindelijk leidt tot het azafenestraan 10 dat als zijn boraanzout wordt geïsoleerd.

In het boraanzout blijkt de N-C-C-bindingshoek 126° te zijn.
In de synthese van [4.6.4.6]fenestrenen en [4.6.4.6]fenestradienen wordt een ongebruikelijke cascade-reactie beschreven: een 8π-disrotatorische-6π-conrotatorische elektrocyclische reactie met als doel het aantal afzonderlijke reactiestappen in de synthese van een fenestraan te minimaliseren.[4]

Bronnen, noten en/of referenties
|
