Gramkleuring
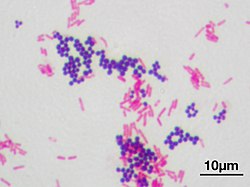
Gramkleuring is een methode om bacteriën te kleuren om ze onder een lichtmicroscoop zichtbaar te maken en als hulpmiddel bij het herkennen van soorten. Met behulp van gramkleuring vallen bacteriën uiteen in twee verschillend aankleurende groepen, die men gramnegatief (rood) of grampositief (blauwpaars) noemt. De methode is genoemd naar de uitvinder ervan, de Deense microbioloog Hans Christian Gram (1853-1938), die de techniek in 1884 ontwikkelde voor het onderscheiden van pneumokokken (Streptococcus pneumoniae) van Klebsiella pneumoniae.[1]
Gramkleuring van bacteriën is mogelijk door de verschillende chemische en fysische eigenschappen van hun celwanden. Grampositieve cellen hebben een dikke laag peptidoglycaan in hun celwand die de kleurstof kristalviolet gemakkelijk opneemt. Gramnegatieve cellen hebben een dunnere peptidoglycaanlaag waardoor het kristalviolet kan worden uitgewassen. Deze bacteriën worden roze gekleurd door een tegenkleuring, gewoonlijk met safranine of fuchsine.[2]
Werking[bewerken | brontekst bewerken]
De bacteriën worden eerst gekleurd met een kristalviolet-jodium complex, daarna gewassen met alcohol en vervolgens nagekleurd met waterige fuchsine. Bij grampositieve bacteriën wordt het kristalviolet-jodiumcomplex niet weggewassen door de alcohol; deze cellen kleuren blauwpaars. Gramnegatieve cellen verliezen de eerste kleurstof weer door het alcoholbad; door de nakleuring met fuchsine kleuren ze daarna rood. Van belang is wel, dat voor de gramkleuring enkel bacteriën worden gebruikt uit een 24 uur oude cultuur, omdat in oudere culturen gramvariabiliteit kan optreden.
Verklaring[bewerken | brontekst bewerken]
Het verschil tussen gramnegatieve en grampositieve bacteriën wordt veroorzaakt door een verschil in de structuur van de celwand:
- Grampositieve bacteriën hebben een dikke peptidoglycaanlaag die ondoordringbaar is voor het alcoholmengsel, waardoor deze niet worden ontkleurd.
- Gramnegatieve cellen hebben buiten het cytoplasmamembraan een heel dunne peptidoglycaanlaag.

Buiten de dunne laag peptidoglycaan zit nog een tweede membraan. Dat buitenmembraan bevat lipopolysacchariden (kortweg LPS), die de cel een extra bescherming bieden. Dit lipopolysacharidemembraan is op te delen in 2 soorten:
- het kernlipopolysacharidemembraan
- het O-lipopolysacharidemembraan
- de celwand bevat verschillende antigenen:
- H-antigenen: flagellen
- O-antigenen: celwand
- K-antigenen: koolhydraat kapsel
Het kernlipopolysacharidemembraan zit dichter op de bacterie terwijl het O-lipopolysacharidemembraan de buitenste buitenkant is van elke gramnegatieve bacterie. De celwand van gramnegatieve bacteriën verliest het kristal-violet van de eerste kleuring bij het spoelen met alcohol weer en kleurt rood, terwijl die van de grampositieve het kristalviolet wel permanent absorbeert ten gevolge van een bindingsreactie met de lugol, waardoor de bacteriën de paars-blauwe kleur vasthouden.
Uitvoering[bewerken | brontekst bewerken]
- Markeer de bovenkant van een voorwerpglaasje met een krasstaafje.
- Breng op een voorwerpglas met behulp van een entoog een druppel steriel fysiologisch water (0,9% NaCl) en strijk deze uit (fysiologisch water is alleen nodig in geval van een 'vaste bacteriecultuur').
- Suspendeer een zeer geringe hoeveelheid bacteriemateriaal in de druppel en strijk deze uit over het glas (over een oppervlak van ongeveer een euro).
- Laat drogen aan de lucht (of hoog boven de vlam).
- Fixeer door driemaal kort door de vlam te halen en laat afkoelen.
- Kleur het preparaat minstens 1 minuut met kristalvioletoplossing en spoel daarna voorzichtig met water.
- Behandel met lugol (een oplossing van jodium in een kaliumjodideoplossing), 1 minuut.
- Giet de lugol af (niet spoelen) en ontkleur 20 seconden met 96% alcohol en spoel met water na.
- Kleur 1 minuut na met waterige fuchsine.
- Spoel goed met water, vloei voorzichtig af tussen filtreerpapier en laat het preparaat drogen aan de lucht. Het kan dan onder de microscoop met olie-immersie worden bekeken (geen dekglaasje!).
Klinische belang[bewerken | brontekst bewerken]
Het maakt voor het beloop van de ziekte en de keuze van de behandeling verschil of de infectie door een grampositieve of een gramnegatieve bacterie veroorzaakt wordt. Over het algemeen treedt penicillineresistentie (ongevoeligheid) bij grampositieve bacteriën minder op dan bij gramnegatieve, tenzij ze het enzym bètalactamase kunnen produceren. Bij resistentie ligt een lactamaseresistent smalspectrumpenicilline als flucloxacilline of toevoeging van de lactamaseremmer clavulaanzuur meer voor de hand dan breedspectrum penicillines als amoxicilline. Gramnegatieve bacteriën zorgen met hun LPS-laag dat het menselijk immuunsysteem sterk reageert op penicilline; de dode bacteriën zijn zelf een endotoxine waar je ziek van kunt worden. Een exotoxine is een gifstof die een (meestal grampositieve) bacterie (zoals de difterie- of de tetanusbacterie of ook Staphylococcus aureus) produceert.
Voorbeelden[bewerken | brontekst bewerken]
Enkele voorbeelden van grampositieve (gram+) bacteriën zijn:
- Streptokokken (o.a. veroorzakers van tandbederf)
- Lactococcus lactis (toegepast bij kaasbereiding)
- Lactobacillus acidophilus (toegepast in gefermenteerde zuivelproducten)
- Lactobacillus casei (toegepast in gefermenteerde zuivelproducten)
- Bacillus anthracis (miltvuurbacterie)
- Stafylokokken
Enkele voorbeelden van gramnegatieve (gram–) bacteriën zijn:
- Salmonella (sommige soorten zijn onschadelijk, andere kunnen voedselvergiftiging of buiktyfus veroorzaken)
- Campylobacter
- Meningokok (kan hersenvliesontsteking (meningitis) veroorzaken)
- Neisseria gonorrhoeae (kan de geslachtsziekte gonorroe veroorzaken)
- Pseudomonas aeruginosa (komt voor als ziekenhuisbacterie)
- Chlamydia trachomatis (veroorzaakt chlamydiasis)
Jonge culturen van Clostridium zijn meestal grampositief, oudere meestal gramnegatief.
In de volgende tabel enkele grampositieve en -negatieve bacteriën die in een direct preparaat zichtbaar kunnen zijn:
| ziekteverwekker onder microscoop | gevonden in | ziekte | bacteriesoorten | antibiotica[3] |
|---|---|---|---|---|
| Gramnegatieve kokken | urethrale uitvloed of vaginale afscheiding | gonorroe | gonokokken | penicilline eventueel met clavulaanzuur |
| Gramnegatieve kokken | liquor (ruggenprik) | hersenvliesontsteking | meningokokken | penicilline |
| Grampositieve kokken in rijtjes of tweetallen | sputum, pus | longontsteking; wondinfectie; | Streptokokkensoorten | penicilline |
| Grampositieve kokken in groepjes | pus | wondinfecties, huidinfecties, botinfectie | Stafylococcus aureus; | flucloxacilline, Levofloxacine EG |
| Gramnegatieve staafjes | urine; sputum | urineweginfectie; luchtweginfectie | Vele; onder meer E. Coli; Enterobacteriaceae; Proteus; Klebsiella; Haemophilus influenzae; Pseudomonas aeruginosa | Amoxicilline, andere breedspectrumantibiotica |
| Grampositieve staafjes | ascitesvocht; gangreen | Listeriose; gasgangreen | Listeria monocytogenes, Bacterioides | Penicilline, vanwege de ernst vaak met een aminoglycoside |
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|
