Hybridisatie (scheikunde)
Hybridisatie is het combineren van elektronenorbitalen van een atoom. Het begrip hybridisatie wordt in de scheikunde gebruikt om de vorming van chemische bindingen te beschrijven en te verklaren. Tijdens de hybridisatie worden ongelijksoortige orbitalen gecombineerd tot een nieuwe set gelijkwaardige orbitalen. De ruimtelijke ordening van de betrokken orbitalen verandert ook. Hierdoor ontstaan andere, en meestal meer, mogelijkheden tot covalente bindingen.
Hybridisatie, ‘bastaardvorming’, is een klassiek begrip uit de biologie (muilezel, lijger) en de taalkunde (biodiversiteit, deskundoloog, vrijage, als woordvormen), het onderling kruisen of aan elkaar paren van ongelijksoortige, heterogene elementen. De chemicus Linus Pauling gebruikte het woord in deze chemische betekenis omstreeks 1931 voor het eerst als concept in zijn fundamentele onderzoek naar kwantumtheoretische modellen voor de chemische binding.
Chemische bindingen, covalente en polaire bindingen, tussen atomen kunnen worden gevormd wanneer twee atomen die vlak bij elkaar liggen twee orbitalen hebben waarvan overlap energetisch gunstig is en wanneer in de beide orbitalen samen minstens twee elektronen zitten.
Atoomorbitalen hebben doorgaans een vorm die een overlap heel ongunstig maakt. Alleen in de H2-molecule is het mogelijk om atoomorbitalen simpel met elkaar te laten overlappen: het 1s-orbitaal van het ene atoom, en het 1s-orbitaal van het andere atoom overlappen elkaar. Voor de elementen met meer elektronen en orbitalen spelen vrijwel altijd combinaties (wiskundig gezien zijn dit lineaire combinaties van golffuncties) van de atoomorbitalen een rol. Het vormen van deze combinaties wordt het hybridiseren genoemd.
Orbitalen combineren[bewerken | brontekst bewerken]


Voor de meest simpele gevallen worden eenvoudige lineaire combinaties van atoomorbitalen gemaakt tussen de s- en p-orbitalen uit de valentieschil van de atomen in een molecuul. De combinaties hebben specifieke rangschikkingen die afhangen van het type menging:
- Wanneer de s orbitaal combineert met een enkele p orbitaal worden 2 sp orbitalen gevormd (één naar links en één naar rechts), en blijven er loodrecht daarop 2 p orbitalen over. De twee sp-orbitalen kunnen elk ingezet worden om een σ-binding aan te gaan (of vrije vrije elektronenparen te plaatsen) de p-orbitalen kunnen ingezet worden in 1 of 2 π-bindingen.
- Wanneer de s orbitaal combineert met twee p orbitalen worden 3 sp2 orbitalen gevormd (onder een hoek van 120° in een plat vlak), en blijft er loodrecht op dat vlak 1 p orbitaal over. Afhankelijk van het atoom kunnen 1, 2 of 3 σ-bindingen en 1 π-binding gevormd worden.
- Wanneer de s orbitaal combineert met drie p orbitalen worden 4 sp3 orbitalen gevormd, het atoom vormt het midden van een tetraëder met de hybride-orbitalen wijzend naar de vier punten. (elk geschikt voor 1 σ-binding of vrije elektronenpaar)
Voorbeelden van eenvoudige hybridisatiemodellen[bewerken | brontekst bewerken]
Het bekendste voorbeeld waarin hybridisatie optreedt, is koolstof. Het element koolstof bezit zes elektronen, waarvan vier in de valentieschil. De elektronenconfiguratie ziet er dus als volgt uit: twee elektronen op de 1s-schil, twee elektronen op de 2s-schil en twee elektronen op de 2p-schil. Men noteert de elektronenconfiguratie op de volgende manier:
- 1s2 2s2 2p2
of in een verkorte notatie als:
- [He] 2s2 2p2
waarin [He] de edelgasconfiguratie van helium weergeeft.
De stabiliteitsregels stellen dat de stabielste elektronenconfiguratie de edelgasconfiguratie is, ofwel een volledig bezet subniveau, en als dat niet kan bereikt worden, een half bezet subniveau. Als we deze stabiliteitsregels op koolstof toepassen, dan krijgen we de volgende situatie:
- 1s2 2s1 2p3
of als:
- [He] 2s1 2p3
Hierbij wordt een elektron uit het 2s-orbitaal gehaald en in een 2p-orbitaal geplaatst. Zodoende verkrijgt koolstof vier halfgevulde orbitalen.
Symmetrie, coördinatiegetal en oxidatiegetal[bewerken | brontekst bewerken]
Indien men nu de verbindingen koolstofdioxide (CO2), fosgeen (COCl2) of tetrachloormethaan (CCl4) zou willen vormen, dan heeft men daarvoor verschillende hybriden nodig omdat de oxidatiegetallen voor de koolstofatomen gelijk zijn (+4) maar de symmetrieën en de coördinatiegetallen van de polaire verbindingen verschillen (4, 2 en 3*). De chlooratomen vormen enkele σ-bindingen met het koolstofatoom terwijl de zuurstofatomen dubbele bindingen met het koolstofatoom vormen, elk bestaande uit een σ-binding en een π-binding.
De s- en p-orbitalen kunnen uitgedrukt worden als hun sferische harmonischen:
De elektronen worden in de hybriden anders over de beschikbare 2s- en 2p-orbitalen verdeeld:
| Orbitalen | ||||
|---|---|---|---|---|
| Vrij atoom | 2 | 1 | 1 | 0 |
| Hybride | 1 | 1 | 1 | 1 |
Als we aannemen dat het verschil in energie tussen de configuraties gegeven wordt door het verschil in de bindingsenergie of de ionisatie-energie van het laatste elektron (E2s of E2p), dan is de energie van het vrije atoom:
- Evrij = 2 E2s + 2 E2p
en de energie van de hybride configuratie:
- Ehybride = E2s + 3 E2p
zodat het energieverschil gelijk is aan ΔE = E2s - E2p.
sp-hybride[bewerken | brontekst bewerken]

Het koolstofdioxidemolecuul is een lineair molecuul met een centraal koolstof atoom op positie (0,0,0) tussen twee zuurstofatomen op de posities (a,0,0) en (-a,0,0). Het koolstof atoom heeft twee sp-hybriden die de σ-bindingen vormen met de half-gevulde 2px-orbitalen op de zuurstofatomen. Daarnaast heeft koolstof half-gevulde 2py- en een 2pz-orbitalen waarmee het π-bindingen kan vormen met de half-gevulde 2py- en 2pz-orbitalen op de zuurstofatomen.
| Hybride |
|---|
sp2-hybride[bewerken | brontekst bewerken]
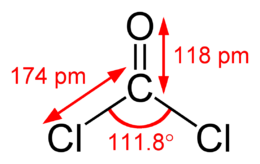
Het fosgeenmolecuul is een vlak molecuul met een tweevoudige rotatiesymmetrie met een rotatieas en twee spiegelvlakken die door as van de C-O binding lopen. De chlooratomen en het zuurstofatoom liggen in het xy-vlak rond het centrale koolstofatoom op positie (0,0,0). Het zuurstofatoom ligt op positie (a,0,0) en de chlooratomen liggen op de posities (-c,b,0) en (-c,-b,0). De drie σ-bindingen worden bij benadering gevormd door drie half-gevulde koolstof sp2-hybriden met twee half-gevulde chloor 3p-orbitalen en een half-gevulde zuurstof 2p-orbitaal. De π-binding tussen het koolstofatoom en het zuurstofatoom wordt door de resterende half-gevulde 2pz-orbitalen op beide atomen gevormd.
| Hybride |
|---|
sp3-hybride[bewerken | brontekst bewerken]
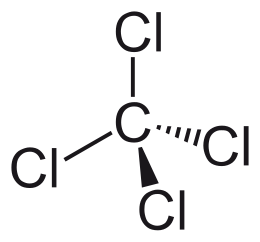
Het koolstofatoom in tetrachloormethaan heeft een tetraëderische omringing die gevormd wordt door de σ-bindingen van het koolstofatoom op positie (0,0,0) met de vier chlooratomen op de posities (a,a,a), (a,-a,-a), (-a,a,-a) en (-a,-a,a). De half-gevulde 3p-orbitalen op de chlooratomen vormen de bindingen met vier koolstof-sp3-hybriden. Het is met röntgendiffractie aan te tonen dat alle hoeken van een CCl4-molecule gelijk zijn (± 109°).
| Hybride |
|---|
Toekennen van de hybridisatietoestand[bewerken | brontekst bewerken]

Als een atoom covalent gebonden bindingspartners heeft, dan moet men (behalve voor waterstof en fluor) het hybridisatiemodel toepassen. Vooral voor koolstof, zuurstof en stikstof levert dit een goede beschrijving van het gedrag van de atomen in verbindingen.
Vervolgens moet bepaald worden welk type hybridisatie optreedt. Hiervoor is er een eenvoudige regel: het aantal bindingsrichtingen dat men nodig heeft om de bindingen te kunnen vormen, bepaalt het aantal noodzakelijke gehybridiseerde orbitalen. Een σ-binding en een vrij elektronenpaar tellen als bindingsrichting.
Eenvoudige hybridisaties[bewerken | brontekst bewerken]
Volgens bovenstaande regel, geldt voor de volgende atomen:
- koolstof in methaan (4 bindingsrichtingen): 4 σ-bindingen, dus 1 s- en 3 p-orbitalen verenigen zich met elkaar (sp3)
- koolstof in etheen (3 bindingsrichtingen): 3 σ-bindingen, dus 1 s- en 2 p-orbitalen verenigen zich met elkaar (sp2)
- koolstof in ethyn (2 richtingen): 2 σ-bindingen, dus 1 s- en 1 p-orbitaal verenigen zich met elkaar (sp)
- zuurstof in water, alkanolen en ethers: 2 σ-bindingen en 2 vrije elektronenparen, dus 1 s- en 3 p-orbitalen verenigen zich met elkaar (sp3)
- zuurstof in aldehyden, ketonen en het dubbel gebonden zuurstofatoom in carbonzuren, esters en amiden: een σ-binding en twee vrije elektronenparen, dus 1 s- en 2 p-orbitalen verenigen zich met elkaar (sp2)
- stikstof in ammoniak: 3 σ-bindingen en 1 vrij elektronenpaar, dus 1 s- en 3 p-orbitalen verenigen zich met elkaar (sp3)
Complexe hybridisaties[bewerken | brontekst bewerken]
Wanneer atomen in de derde of hogere periodes hybride orbitalen vormen, kunnen ook d (of zelfs f) orbitalen meegehybridiseerd worden. Dit levert een rijk gamma aan verschillende mogelijkheden voor omringing op dat zich uit in de zeer diverse omringingsvoorkeuren van de overgangsmetalen. Het is heel moeilijk om deze omringingen te voorspellen, maar met behulp van de hybridisatietheorie en wat driedimensionaal inzicht zijn ze allemaal relatief eenvoudig te verklaren.
Meer gecompliceerde verbindingen (zoals coördinatieverbindingen), kunnen ook een d-orbitaal betrekken bij hun hybridisatie. Zo is de hybridisatietoestand voor jood in de molecule joodpentafluoride (IF5) gelijk aan sp3d2. Dit is te wijten aan het feit dat jood vijf σ-bindingen aangaat met fluor en nog een vrij elektronenpaar heeft. Er moeten dus telkens zes orbitalen gebruikt worden om een binding aan te gaan: dat betekent 1 s-, 3 p- en 2 d-orbitalen.
Bindingen[bewerken | brontekst bewerken]
Twee orbitalen (hybride of atoomorbitalen) met een soortgelijke symmetrie, die in naast elkaar liggende atomen liggen, kunnen tot een binding leiden. Er kunnen zelfs meerdere paren orbitalen tussen hetzelfde paar atomen worden gevormd, dit is een meervoudige binding. De eerste binding tussen twee atomen wordt een σ-binding genoemd. Een σ-binding wordt gekenmerkt door een overlapzone met de grootste elektronendichtheid gesitueerd op de bindingslijn tussen de twee atomen. Dit gebeurt wanneer de orbitalen elk naar het andere atoom "wijzen". Er is een rotatiesymmetrie om een σ-type binding, en de overlap tussen de orbitalen blijft bij rotatie bestaan.
Indien er meer dan één binding is tussen twee atomen (bijvoorbeeld in C2H4 en N2) overlappen de orbitalen die daarvoor verantwoordelijk zijn aan twee kanten van de bindings-as (boven en onder het vlak, of voor en achter het vlak). Deze bindingen worden π-bindingen genoemd. Wanneer er een π-binding tussen twee atomen zit, heeft die binding geen rotatievrijheid meer (draaien om de binding zou de overlap tussen de orbitalen verminderen).
π-bindingen worden meestal gevormd door ongehybridiseerde p-orbitalen op de twee atomen. Als twee atomen dus één dubbele binding vormen, zullen de rest van de orbitalen (1 s en 2 p orbitalen) tot sp2 hybridiseren. Een ander voorbeeld: als een atoom twee dubbele bindingen vormt, blijven er 1 s en 1 p (bijvoorbeeld px) orbitaal over om 2 sp orbitalen te vormen. Deze wijzen respectievelijk naar links en naar rechts. Een van de overblijvende p orbitalen (bijvoorbeeld pz) vormt een dubbele binding "boven en onder" met een tweede atoom, en de ander (py) "voor en achter" met een derde atoom.



















