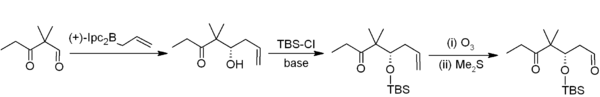Organoboorchemie
De organoboorchemie is die tak van de chemie waarin verbindingen worden bestudeerd waarin een directe binding optreedt tussen koolstof en boor. Een verbinding uit deze groep wordt aangeduid als organoboraan. Door sommigen wordt boor als een metaal beschouwd, waarmee de organoboorchemie een subdiscipline vormt van de organometaalchemie. De organoboranen kunnen beschouwd worden als derivaten van BH3, bijvoorbeeld de trialkylboranen.[1][2] De organoboranen bieden een uitgebreid scala aan reactiemogelijkheden, waarvan de meest gebruikte de hydroborering is.
Eigenschappen[bewerken | brontekst bewerken]
De koolstof-boorbinding vertoont een lage polariteit, het verschil in elektronegativiteit tussen koolstof (2,55) en boor (2,04) is klein en vergelijkbaar met het verschil tussen koolstof en waterstof. Het gevolg is dat alkylboranen in het algemeen stabiele verbindingen zijn, hoewel gevoelig voor oxidatie. Treden vinyl- of aryl-groepen op als substituent., dan worden elektronen uit het π-systeem in de lege boor-orbitaal gedoneerd, waardoor boor minder elektrofiel wordt en de koolstof-boorbinding het karakter van een dubbele binding krijgt. Net als de stamverbinding diboraan, vormen de organoboranen sterke elektrofielen omdat het voor boor niet mogelijk is een compleet octet elektronen op te bouwen. In tegenstelling tot diboraan vormen de organoboranen geen dimeren.
Boranen met speciale eigenschappen zijn de
- carboranen, clusterverbindingen van koolstof en boor en
- borabenzeen, benzeen waarin een van de C-H-eenheden vervangen is door een booratoom.
Borinaat, boronaat, boraat, boryl en boryleen[bewerken | brontekst bewerken]
Wordt de directe binding tussen boor en koolstof vervangen door een binding via een zuurstofatoom dan ontstaan achtereenvolgens borinaatesters R2BOR, boronaatesters RB(OR)2 en boraten B(OR)3 zoals trimethylboraat. In de organometaalchemie zijn de borylen (M–BR2) en de borylenen (M–B(R)–M) bekend - de 'M' staat voor een willekeurig metaal.
Synthese[bewerken | brontekst bewerken]
Uit Grignardverbindingen[bewerken | brontekst bewerken]
Eenvoudige, symmetrische organoboranen (tri-ethylboraan of tris(pentafluorfenyl)boraan) kunnen uit boortrifluoride (in ether) en de ethyl- of pentafluorfenyl-Grignard-reagentia gemaakt worden.
Uit alkenen[bewerken | brontekst bewerken]
Boranen reageren snel met alkenen in een reactie die aangeduid wordt als hydroborering. Deze reactie werd ontdekt door Herbert Brown, werk waarvoor hij in 1979 de Nobelprijs kreeg (samen met Georg Wittig voor zijn ontdekking van de Wittig-reactie). Naar de letter - zeker van de oorspronkelijke formulering - van de regel van Markovnikov vindt de additie anti-Markovnikov plaats: het waterstofatoom komt aan het meest vertakte koolstofatoom. De achtergrond hiervan is dat de regel van Markovnikov gebaseerd was op reacties van alkenen met verbindingen waarin waterstof het positieve deeltje was. In boranen is waterstof elektronegatiever dan boor. Omdat de sturing samenhangt met de lading van het intermediaire deeltje wordt waterstof nu voornamelijk aan het meest vertakte koolstofatoom gebonden.
Dit verschijnsel treedt bij alle boranen op, maar vooral op bij boranen met grote substituenten gaat de sturing over naar exclusiviteit. Een om die reden veelgebruikt organoboraan is 9-BBN.[3] Hydroborering is een stereospecifieke reactie: de twee groepen adderen syn aan de dubbele binding van het alkeen. Het is bovendien een geconcerteerde reactie, in de overgangstoestand vormen de twee koolstofatomen van het alkeen, het waterstofatoom en het booratoom een vierkant met maximale overlap tussen de twee p-orbitalen van het alkeen en de lege orbitaal op boor.
Reacties[bewerken | brontekst bewerken]
Hydroborering[bewerken | brontekst bewerken]
In de organische synthese is de hydroborering meestal geen doel op zich, maar wordt de reactie vaak gevolgd door een oxidatie, waarbij andere functionele groepen de plaats van het booratoom innemen. Met waterstofperoxide worden alcoholen gevormd, de sterkere oxidator chroom(VI)oxide leidt tot carbonylverbindingen.
Omleggingen[bewerken | brontekst bewerken]
Een tweede groep reacties van organoboorverbindingen wordt gevormd door die waarin een nieuwe koolstof-koolstofbinding ontstaat. Koolstofmonoxide reageert heel makkelijk met trialkylboranen. Er volgt een 1,2-omlegging waarbij een alkylgroep van het negatief geladen booratoom verschuift naar het ernaast gelegen elektrofiele koolstofatoom. De carbonylgroep kan vervolgens (eventueel) gereduceerd worden naar een alcohol.
Allylborering[bewerken | brontekst bewerken]
De asymmetrische allylborering is een andere in de synthese goed bruikbare koppelingsreactie van boranen.[4] In dit voorbeeld van de synthese van epothilonen door Nicolaou,[5] wordt een asymmetrische allylborering (door een allylboraan op basis van het chirale α-pineen) in combinatie met silylethers en ozonolyse uitgevoerd. De over-all reactie komt neer op een homologatie met twee koolstofatomen, waarmee het benodigde acetogenine verkregen wordt.
Transmetallering[bewerken | brontekst bewerken]
Organoboorverbindingen kunnen met organopalladiumverbindingen een transmetalering ondergaan, de Suzuki-reactie is daar een voorbeeld van.
Als reductor[bewerken | brontekst bewerken]
Boraanhydriden als 9-BBN en L-selectride (lithium tri-s-butylboorhydride) zijn reductoren. Ze worden onder andere ingezet als asymmetrische katalysator in de reductie van carbonylverbindingen. Een voorbeeld is de CBS-katalysator. Het boor fungeert in deze katalysator als ankerpunt voor de ermee complexerende zuurstofatomen uit de carbonylgroepen.
Boraten[bewerken | brontekst bewerken]
Trialkylboranen, BR3, kunnen geoxideerd worden tot de overeenkomstige boraten, B(OR)3. Een van de methoden om het aantal koolstof-boorbindingen vast te stellen is de oxidatie van het boraan met trimethylamineoxide (Me3NO) tot B(OR)3. Het vrijgekomen trimethylamine (Me3N) kan vervolgens via een titratie bepaald worden.
Boronzuren (RB(OH)2) reageren met kaliumwaterstoffluoride K[HF2] tot trifluorboraten (K[RBF3])[6] waaruit vervolgens nucleofiele alkyl- en aryl- boordifluoriden (ArBF2) gemaakt kunnen worden.[7] De zouten zijn stabieler dan de vrije zuren en worden toegepast bij het alkyleren van bepaalde aldehyden:[8][9]
Boryllithium[bewerken | brontekst bewerken]
Nucleofielen met een negatief geladen booratoom hebben lange tijd alleen in chemische dagdromen bestaan. In 2006 werd het bestaan van boryllithiumverbindingen, die zich gedroegen als het gezochte nucleofiel, aangetoond:[10][11]
Deze late ontdekking van de directe boor-lithiumverbinding is deels opmerkelijk, omdat alle andere elementen uit de tweede periode van het periodiek systeem (LiF, LiOH, LiNH2 en LiCH3) vlot aan lithium binden, soms worden zelfs zeer sterke bindingen gevormd. De reactie van een base met een boorhydride R2BH heeft niet de deprotonering tot het borylanion R2B− tot gevolg, maar de vorming van het anion R2B−H(base), alleen op deze manier is het octet voor boor vol te krijgen.[12] In plaats van een base te gebruiken wordt een reductieve heterolitische splitsing van een boor-broombinding door metallisch lithium uitgevoerd. De borylverbinding lijkt in zijn chemie erg op N-heterocyclische carbenen en is daar ook iso-elektronisch mee. De verbinding is ontworpen om te profiteren van
- en de aromatische stabilisatie: een 6 elektronensysteem (1 van elk koolstof-atoom, 2 van elk vrij elektronenpaar op de stikstofatomen) in een cyclische configuratie waarin de lege orbitaal van boor het gat tussen de twee stikstofatomen vult (zie structuur A)
- en de kinetische reactiecontrole door de grote 2,6-di-isopropylfenylgroepen. Röntgenanalyse bevestigd de sp2-hybridisatie van boor en ook de nucleofiele additie aan benzaldehyde ondersteund de voorgestelde structuur.
Alkylideenboranen[bewerken | brontekst bewerken]
Alkylideenboranen van het type RB=CRR, er treedt een dubbele binding op tussen koolstof en boor, zijn een chemische rariteit. Een van de weinige voorbeelden is borabenzeen. Het bestaan van de stamverbinding van de alkylideenboranen, HB=CH2, kan bij lage temperatuur worden vastgesteld. Een tamelijk stabiel derivaat is CH3B=C(SiMe3)2, maar de verbinding is gevoelig voor cyclodimerisatie.[13]
Diborenen[bewerken | brontekst bewerken]
Verbindingen waarin een dubbele binding tussen twee booratomen optreedt worden diborenen genoemd. Net als de dubbele binding tussen koolstof en boor is ook de dubbele binding tussen twee booratomen een zeldzaamheid. In 2007 is het eerste neutrale diboreen (RHB=BHR) beschreven[14] Het boor wordt in de vorm van Boortribromide in de reactie gebracht, de reductor is een KC8 die de benodigde protonen aan het oplosmiddel di-ethylether onttrekt. In het diboreen is elk booratoom gebonden aan een waterstofatoom en aan een stabiel carbeen.
Borolen[bewerken | brontekst bewerken]
Van de borolen, cyclische verbindingen analoog aan pyrrool, is de stamverbinding nog niet beschreven. Een aantal derivaten zijn wel bekend.
Borabenzeen[bewerken | brontekst bewerken]
Borabenzeen, benzeen waarin één CH-groep vervangen is door een boor-atoom, is alleen bekend uit adducten. Het is een dusdanig sterk Lewiszuur, dat het tot 2023 niet mogelijk is gebleken de verbinding puur te isoleren. Als Lewisbase treden bijvoorbeel pyridine of fosfines op.
De verbinding is, vanuit organisch chemisch oogpunt bezien wel vreemd: Boor draagt geen elektron bij aan het -systeem, erger nog, het onttrekt er een. In moeten de volgende elektronen geplaatst worden:
Element e- per element Aantal Totaal Koolstof 6 5 30 Waterstof 1 5 5 Boor 5 1 5 Totaal 40
| Het opvullen van de moleculaire orbitalen verloopt als volgt: De 1s orbitalen van koolstof hebben de laagste energie, gevolgd door die op boor. Vervolgens zijn de sigma-bindingen tussen de koolstof-atomen aan de beurt. De koolstof-atomen hebben de hoogste kernlading dus zullen in het sigma-skelet de laagste energie voor de bindingen opleveren. Daarna volgen de koolstof-boor- en als laatste in het sigma-skelet de koolstof-watersrofbindingen. De niet voor een binding naar koolstof-atomen gebruikte sp2orbitaal op boor is dan aan de beurt, deze orbitaal krijgt een "lone pair". Vervolgens blijven er nog vier elektronen over voor het -systeem. |
Orbitaal | Aantal | Totaal e- | Cumulatief |
|---|---|---|---|---|
| C-1s | 5 | 10 | 10 | |
| B-1s | 1 | 2 | 12 | |
| 4 | 8 | 20 | ||
| 2 | 4 | 24 | ||
| 5 | 10 | 34 | ||
| 1 | 2 | 36 | ||
| 4 | 40 |
Op het moment dat een adduct zich vormt, wordt de lone-pair orbitaal op boor bezet door de elektronen van de Lewisbase, en komen de elektronen die daar in het vrije borabenzeen geplaatst hadden moeten worden beschikbaar voor het -systeem.
Andere toepassingen[bewerken | brontekst bewerken]
Tri-ethylboraan, TEB, wordt toegepast als ontsteker voor JP-7-brandstof van de Pratt/Whitney J-58-ramjetmotor in de Lockheed SR-71 Blackbird.
Bronnen, noten en/of referenties
|