Organostikstofchemie
De organostikstofchemie bestudeert de koolstof-stikstof-binding, een covalente binding tussen koolstof en stikstof. Het is een van de meest voorkomende bindingen, na koolstof-koolstof, in de organische chemie en de biochemie.[1]
Stikstof heeft vijf valentie-elektronen in eenvoudige amine's is het driewaardig, waarbij de overblijvende elektronen een vrij elektronenpaar vormen. Via het vrije elektronenpaar kan stikstof een extra binding aangaan met bijvoorbeeld waterstofionen, waarmee het tetravalent wordt, en bovendien een positieve lading krijgt zoals in de ammoniumzouten. Veel organische stikstofverbindingen zijn daarmee ook potentiële basen, de basesterkte is afhankelijk van de verdere configuratie. Amiden zijn nauwelijks basisch door de delocalisatie van het vrije elektronenpaar naar de ernaast gelegen carbonylgroep, in pyrrool blijft weinig van de basesterkte over door de deelname van het vrije elektronenpaar aan het aromatisch sextet.
Net als tussen koolstofatomen zijn tussen koolstof en stikstof dubbele bindingen, zoals in imines, en drievoudige bindingen mogelijk, zoals in de nitrillen. De bindingslengte loopt uiteen van 147,9 pm bij eenvoudige amines en 147,5 pm in C-N= verbindingen (nitromethaan) tot 135,2 pm in gevallen waar een partiële dubbele binding optreedt (pyridine) en 115,8 pm in drievoudige binding van de nitrillen.[2]
De koolstof-stikstofbinding is gepolariseerd met stikstof aan de negatieve zijde, het verschil in elektronegativiteit, C met 2,55 en N 3,04, kan in hoge moleculaire dipolen resulteren: cyaanamide 4,27 D, diazomethaan 1,5 D, methylazide 2,17 D, pyridine 2,19 D. Deze grote dipool ligt ook aan de basis van de wateroplosbaarheid van veel organische stikstofverbindingen.
Functionele groepen met stikstof[bewerken | brontekst bewerken]
| Stofklasse | Bindingsorde | Brutoformule | Structuurformule | Voorbeeld | Gemiddelde C–N bindingslengte (pm)[3] |
|---|---|---|---|---|---|
| Amines | 1 | R2C-NH2 | 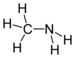 Methylamine |
146,9 (neutraal amine) 149,9 (ammoniumzout) | |
| Aziridines | 1 | CH2NHCH2 | 
|
 Mitomycine |
147.2 |
| Aziden | 1 | R2C-N3 |  Fenylazide |
||
| Anilines | 1 | Ph-NH2 | 
|
 Anisidine |
135,5 (sp2-N) 139,5 (sp3-N) 146,5 (ammoniumzout) |
| Pyrrolen | 1 | 
|
 Porfyrine |
137,2 | |
| Amiden | 1.2 | R-CO-NR2 | 
|
 Aceetamide |
132,5 (primair) 133,4 (secundair) 134.6 (tertiair) |
| Pyridines | 1.5 | pyr | 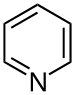
|
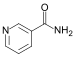 Nicotinamide |
133,7 |
| Imines | 2 | R2C=NR | 
|
 DBN |
127,9 (C=N-binding) 146,5 (C–N-binding) |
| Nitrilen | 3 | R-CN |  Benzonitril |
113,6 | |
| Isonitrilen | 3 | R-NC | TOSMIC |
[bewerken | brontekst bewerken]
Navigatie Koolstof-elementbinding
Bronnen, noten en/of referenties
|
