Peptidebinding
Een peptidebinding is een covalente chemische binding tussen een carboxygroep (-COOH) en een aminogroep (-NH2). Hierdoor kunnen twee of meer aminozuren zich verbinden tot een peptide (keten van aminozuren). De binding ontstaat tussen de carboxylgroep (-COOH) van één aminozuur en de aminogroep (-NH2) van een volgend aminozuur. Alle aminozuren van een proteïne (eiwit) zijn bijvoorbeeld middels peptidebindingen aan elkaar gekoppeld.
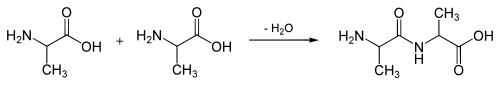
De vorming van een dipeptide uit twee afzonderlijke aminozuren gaat gepaard met het verlies van een watermolecuul (condensatiereactie). Deze ontstaat door het afstaan van een waterstofatoom (H) door de aminogroep en een hydroxylgroep (OH) door de carboxylgroep.
- Voorbeeld:

Het evenwicht van deze reactie ligt naar de linkerkant (dus naar de zijde van de hydrolyse van de peptidebinding); er is energie vereist om een peptidebinding te vormen (endotherme reactie).
Per definitie zegt men dat het amino-uiteinde het chemisch begin is van een proteïne en dat het carboxyl-uiteinde het chemisch einde is van een proteïne. De primaire structuur van een proteïne wordt dus als volgt voorgesteld:
- H2N—az1—az2—az3—az4—........—azN—COOH
Een bekende manier om het voorkomen van een peptidebinding aan te tonen is de biureetreactie.
