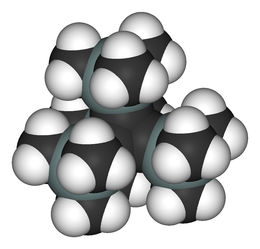
Tetrahedraan

Tetrahedraan is een van de platonische koolwaterstoffen met de chemische formule C4H4 en een tetraëderstructuur (figuur 1). De systematische IUPAC-naam is tricyclo[1.1.0.02,4]butaan. De extreem grote hoekspanning (de hoeken tussen de bindingen van de koolstofatomen zijn 60° in plaats van de normale waarde van 109,5°) voorkomt dat het molecule buiten het laboratorium kan ontstaan.
In 1978 lukte het Günther Maier een stabiel tetrahedraan te maken. Vier tert-butylgroepen, aan elk koolstofatoom één, voorkwamen dat het molecuul reacties kon aangaan.[1] Deze zeer grote substituenten liggen als een envelop rond de reactieve tetrahedraanstructuur. Bindingen in het centrale deel van het molecule kunnen niet verbroken worden, omdat daardoor de substituenten dichter tegen elkaar gedrukt worden wat leidt tot hoge vanderwaalsspanning. De stabilisatie wordt ook wel omschreven als het korseteffect.
Stabiele tetrahedraanderivaten[bewerken | brontekst bewerken]
Tetrakis(trimethylsilyl)tetrahedraan[bewerken | brontekst bewerken]
In Tetrakis(trimethylsilyl)tetrahedraan (Figuur 2) zijn de tert-butylgroepen vervangen door trimethylsilylgroepen.[2] Opmerkelijk genoeg is deze verbinding veel stabieler dan het tert-butylanalogon. De covalente silicium-koolstofbinding is langer dan de koolstof-koolstofbinding, waardoor het korseteffect vermindert. Anderzijds is de trimethylsilylgroep een sigma donor wat de vergrote stabiliteit van de tetrahedraankern verklaart. Terwijl tert-butyl gesubstitueerde tetrahedraan bij 135 °C smelt, en tegelijkertijd de omlegging naar het cyclobutadieen begint, smelt de trimethylsilylverbinding pas bij 202 °C en is hij stabiel tot 300 °C. Bij deze temperatuur ontleed de verbinding naar de uitgangsstof Bis(trimethylsilyl)ethyn.
In de tetrahedraankern van het molecule komen banaanbindingen voor. De binding naar de substituent heeft daardoor een zeer hoog s-orbitaalkarakter, wat normaal gesproken alleen voorkomt in de acetylenen. Ook uit NMR-gegevens kan een sp-hybridisatie afgeleid worden. Het gevolg is dat de bindingslengte een ongebruikelijk lage waarde heeft, slechts 152 pm. De laatste ontwikkeling in de organische synthese is de bereiding en karakterisering van het tetrahedraandimeer (zie figuur hieronder). De verbinding tussen de twee delen van het molecule is slechts 143,6 pm, onwaarschijnlijk kort voor een enkele koolstof-koolstofbinding die normaal 154 pm lang is. De bindingslengte komt zelfs in het bereik dat ook voor een aantal aromatische verbindingen geldt, bijvoorbeeld in naftaleen.
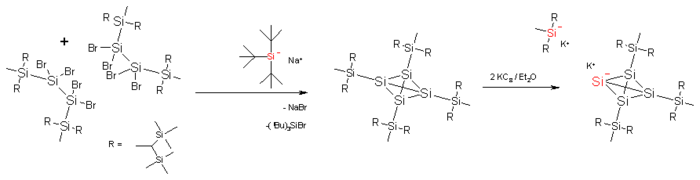
Tetrasilatetrahedraan[bewerken | brontekst bewerken]
In tetrasilatetrahedraan zijn de koolstofatomen in de kern van het molecule vervangen door silicium. De normale silicium-siliciumbinding is veel langer, 235 pm, en de tetrahedraankern is opnieuw ingepakt, nu in vier tristrimethylsilylsilylgroepen. Hierdoor wordt de verbinding thermisch stabiel. Het silatetrahedraan kan met kaliumgrafiet gereduceerd worden tot het kaliumzout van tetrasilatetrahedranide. In deze verbinding heeft een van de siliciumatomen van de kern zijn substituent verloren en draagt een negatieve lading. Het kaliumion kan in een kroonether opgesloten worden. In het resulterende complex zijn het kaliumion en het silylanion gescheiden door een afstand van 885 pm. Een van de Si−–Si-bindingen heeft nu een lengte van 272 pm en het siliciumatoom een omgekeerde tetraedergeometrie. Op de tijdschaal waarop de NMR werkt zijn de vier siliciumatomen equivalent door de snelle uitwisseling van de substituenten langs de atomen van de tetrahedraankooi.[3]
Er is ook geprobeerd de dimerisatiereactie zoals die voor het koolstof-tetrahedraan beschreven is uit te voeren.[4] In dit geval echter wordt de tetrahedraankern beschermd door vier zogenoemde super silyl groepen. Het dimeer kon niet geïsoleerd worden, wel werd een reactie gevonden met jood in benzeen waarbij het ontstane product een reactie met het anion van tri(tert-butyl)silaan geeft waarbij een verbinding met een cluster van acht siliciumatomen ontstaat.
Deze waarneming komt niet overeen met die welke voor andere leden uit de koolstofgroep van het periodiek systeem gedaan zijn. Bij Tin (Sn8R6) en germanium (Ge8R6) bevinden deze zich op de hoekpunten van de kubus, de structuur lijkt daarmee het meest op cubaan.
Bronnen, noten en/of referenties
|