Thiocyaanzuur
| Thiocyaanzuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van thiocyaanzuur
| ||||
| Algemeen | ||||
| Molecuulformule | CHNS | |||
| IUPAC-naam | thiocyaanzuur | |||
| Andere namen | waterstofthiocyanaat | |||
| Molmassa | 59,09034 g/mol | |||
| SMILES | C(#N)S
| |||
| InChI | 1S/CHNS/c2-1-3/h3H
| |||
| CAS-nummer | 463-56-9 | |||
| EG-nummer | 207-337-4 | |||
| PubChem | 781 | |||
| Wikidata | Q25792 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H312 - H332 - H412 | |||
| EUH-zinnen | EUH032 | |||
| P-zinnen | geen | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 2,04 g/cm³ | |||
| Smeltpunt | 5 °C | |||
| Goed oplosbaar in | water | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Thiocyaanzuur is een anorganische verbinding met als brutoformule CHNS. De stof komt voor als een vluchtige kleurloze viskeuze vloeistof met een indringende geur, die mengbaar is met water.
Synthese[bewerken | brontekst bewerken]
Thiocyaanzuur kan bereid worden door de reactie van waterstofsulfide met kwik(II)cyanide. De bereiding in waterige oplossing geschiedt door het toevoegen van verdund zwavelzuur aan een oplossing van ammoniumthiocyanaat. Beide synthesemethoden leveren niet het zuivere product op, maar een isomerenmengsel van thiocyaanzuur en isothiocyaanzuur.
Waterige oplossingen van thiocyaanzuur kunnen ook uit ammoniumthiocyanaat worden bereid door de waterstofvorm van een ionenwisselaar.[1]
Eigenschappen[bewerken | brontekst bewerken]
De verbinding bestaat niet in zuivere vorm, maar vormt een evenwichtsmengsel met een isomere verbinding, isothiocyaanzuur.[2] Dit evenwicht kan herleid worden tot het feit dat thiocyaanzuur een zwak tot matig anorganisch zuur is, met een pKa van 1,1 bij 20°C.[3] Het aanwezige thiocyanaat in de oplossing is in evenwicht met het isothiocyanaatanion, dat op zijn beurt in staat is een proton op te nemen en isothiocyaanzuur te vormen:
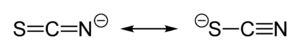
Enkel rond 0°C is thiocyaanzuur stabiel. Bij hogere temperaturen gaat het snel over in polymerisatieproducten.[4] Sterke oplossingen van het zuur ontbinden door ontleding tot het uiterst toxische waterstofcyanide (blauwzuur) en isoperthiocyaanzuur.[5] Bij het mengen van sterke oplossingen met mineraalzuren, ontstaan echter kooldioxide, ammoniak, waterstofsulfide, of carbonylsulfide (koolstofoxysulfide), afhankelijk van de sterkte van het gebruikte mineraalzuur.[4] Verdunde oplossingen (tot 5%) zijn stabiel.[6]
Thiocyaanzuur is het zwavelanaloog van cyaanzuur. De zouten van het thiocyaanzuur worden thiocyanaten genoemd. Een voorbeeld hiervan is natriumthiocyanaat. Daarnaast bestaan ook organische derivaten van dit zuur, zoals ethylthiocyanaat. Die verbinding wordt ingezet als insecticide. Methyleendithiocyanaat, dat twee thiocyanaatgroepen bevat, wordt in koelwatercircuits en in papierfabrieken aangewend om de aangroei van algen, schimmels en bacteriën te verhinderen.
Externe link[bewerken | brontekst bewerken]
- (en) Gegevens van thiocyaanzuur in de GESTIS-stoffendatabank van het IFA
Bronnen, noten en/of referenties
|

