Trimethylchloorsilaan
| Trimethylchloorsilaan | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
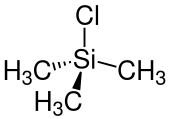
Structuurformule van trimethylchloorsilaan
| |||||

| |||||
Molecuulmodel van trimethylchloorsilaan
| |||||
| Algemeen | |||||
| Molecuulformule | C3H9SiCl | ||||
| IUPAC-naam | trimethylsilylchloride | ||||
| Andere namen | chloormethylsilaan, trimethylsiliciumchloride, TMCS, TMS-Cl | ||||
| Molmassa | 108,64206 g/mol | ||||
| SMILES | C[Si](C)(C)Cl
| ||||
| InChI | 1S/C3H9ClSi/c1-5(2,3)4/h1-3H3
| ||||
| CAS-nummer | 75-77-4 | ||||
| EG-nummer | 200-900-5 | ||||
| PubChem | 6397 | ||||
| Wikidata | Q420183 | ||||
| Beschrijving | Kleurloze vloeistof met scherpe geur | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H225 - H312 - H314 - H331 - H335 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P210 - P261 - P280 - P305+P351+P338 - P310 | ||||
| Opslag | Gescheiden van alcoholen, amines, voeding en voedingsmiddelen. Brandveilig, koel, droog en goed gesloten opslaan. | ||||
| VN-nummer | 1298 | ||||
| ADR-klasse | Gevarenklasse 3 | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vloeibaar | ||||
| Kleur | kleurloos | ||||
| Dichtheid | 0,856 g/cm³ | ||||
| Smeltpunt | −40 °C | ||||
| Kookpunt | 57 - 60 °C | ||||
| Vlampunt | −28 °C | ||||
| Zelfontbrandings- temperatuur | 395 °C | ||||
| Dampdruk | (bij 20°C) 25.300 Pa | ||||
| Goed oplosbaar in | organische oplosmiddelen | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Trimethylchloorsilaan is een organische siliciumverbinding met als brutoformule C3H9SiCl. De stof komt voor als een kleurloze vloeistof met een scherpe geur, die hevig reageert met water.
Synthese[bewerken | brontekst bewerken]
Trimethylchloorsilaan kan worden bereid uit siliciumtetrachloride, door middel van nucleofiele substitutie. Hierbij worden de 3 chloride-groepen vervangen door 3 nucleofiele methylgroepen, meestal afkomstig van methyllithium.
Een andere mogelijkheid is de bereiding via een Müller-Rochowsynthese. Hierbij reageren siliciumpoeder en methylchloride bij een temperatuur van 350°C en met koper als katalysator tot dimethyldichloorsilaan. Deze verbinding disproportioneert verder tot methyltrichloorsilaan en trimethylchloorsilaan:
Toepassingen[bewerken | brontekst bewerken]
Trimethylchloorsilaan kent veel toepassingen in de scheikunde, waar het vooral als bron van trimethylsilylgroepen en watervrije chloride-ionen dient. Functionele groepen, zoals alcoholen en amines, ondergaan een hevige reactie van trimethylchloorsilaan. Hierbij worden respectievelijke de overeenkomstige trimethylsilylethers en trimethylsilylamines gevormd. Hoewel de vormingsreactie van de verbinding tussen trimethylchloorsilaan enerzijds en alcoholen en amines anderzijds heftig verloopt, is ook de splitsingsreactie relatief eenvoudig uit te voeren. Om deze reden wordt trimethylchloorsilaan vaak gebruikt om de alcoholfunctie tijdens de synthese van complexe moleculen te beschermen.
De stof kan ook worden gebruikt om de vluchtigheid van een andere stof te verhogen, zodat niet-vluchtige stoffen (zoals bijvoorbeeld glucose) kunnen worden gebruikt in de gaschromatografie. De vluchtigheid wordt verhoogd, doordat trimethylchloorsilaan met de hydroxylgroepen in glucose reageert. De waterstofbruggen die in glucose zeer sterk zijn kunnen niet meer gevormd worden, zodat de moleculen elkaar niet meer zo sterk aantrekken en de vluchtigheid dus toeneemt.
Verder kan de stof nuttig zijn bij de aanmaak van andere trimethylsilylhalogenen en -pseudohalogenen:
- Trimethylfluorsilaan
- Trimethylbroomsilaan
- Trimethyljoodsilaan
- Trimethylsilylcyanide
- Trimethylsilylazide
- Trimethylsilyltrifluormethaansulfonaat
Ten slotte wordt trimethylchloorsilaan aan laboratoriumglaswerk toegevoegd om het meer lipofiel te maken. In het oppervlak van glas komen nog veel vrije hydroxylgroepen voor. Net als bij de alcoholen reageert trimethylchloorsilaan met deze groepen.
Toxicologie en veiligheid[bewerken | brontekst bewerken]
De stof ontleedt bij verhitting, met vorming van giftige en corrosieve dampen, onder andere waterstofchloride en fosgeen. Ze reageert hevig met water, waardoor waterstofchloride gevormd wordt. Trimethylchloorsilaan reageert hevig met alcoholen en amines, waardoor brand- en ontploffingsgevaar ontstaat. De stof tast vele metalen aan in aanwezigheid van water.
De stof is corrosief voor de ogen, de huid en de luchtwegen. Inademing van de damp kan longoedeem veroorzaken. Blootstelling aan de stof kan de dood veroorzaken.




