Elektronenschil

Elektronenschillen zijn denkbeeldige banen om een atoomkern, waarin zich de elektronen bevinden. De verdeling van de elektronen over de elektronenschillen wordt de elektronenconfiguratie genoemd.
Theorieën[bewerken | brontekst bewerken]
In het atoommodel van Bohr uit 1913 worden met het aantal elektronen in de buitenste elektronenschil de scheikundige eigenschappen van de elementen verklaard. Bohr stelde zich de elektronenschillen voor als concentrische banen, vergelijkbaar met de banen van de planeten in het Zonnestelsel. Zwaardere atomen hebben meerdere schillen, die voorgesteld worden als wijdere banen om de atoomkern. Elke schil heeft een bepaald discreet energieniveau ten opzichte van de atoomkern: de binnenste schillen hebben een lager energieniveau dan de buitenste. Dat laatste betekent dat de elektronen zich normaal gesproken in een zo dicht mogelijk bij de atoomkern liggende schil zullen bevinden. De elektronen beïnvloeden elkaar echter, omdat het geladen deeltjes zijn. Grofweg worden de binnenste schillen het eerst opgevuld maar door de onderlinge afstoting zijn daar uitzonderingen op.
Volgens de moderne kwantumfysica kan Bohrs fysische interpretatie van concentrische banen niet kloppen, omdat een elektron zich niet alleen als een deeltje, maar ook als een golfverschijnsel gedraagt. Oftewel de dualiteit van golven en deeltjes. De schil is niet een concentrische baan, maar een staand golfpatroon met buiken en knopen, dat in de kwantumfysica een orbitaal genoemd wordt. Daarnaast is niet met zekerheid te zeggen waar een elektron zich op een bepaald moment precies bevindt. Voor iedere orbitaal beschrijft een wiskundige vergelijking, de golffunctie, die een oplossing is van de schrödingervergelijking, de waarschijnlijkheid om het elektron ergens aan te treffen. Het laatste fenomeen werd beschreven door Heisenberg en wordt ook beschreven in het experiment van Schrödingers kat.
Kwantumgetallen[bewerken | brontekst bewerken]
Elektronenschillen worden onderverdeeld in subschillen en banen. Het aantal schillen, subschillen en banen van een atoom wordt gegeven door de zogenaamde kwantumgetallen van het betreffende element. De eerste drie kwantumgetallen zijn: het hoofdkwantumgetal, het nevenkwantumgetal en het magnetische kwantumgetal. Naast de voornoemde drie kwantumgetallen zijn er nog andere, zoals het magnetisch spinkwantumgetal.
Elk van deze kwantumgetallen zal hierna verder worden toegelicht.
Het hoofdkwantumgetal[bewerken | brontekst bewerken]
Het hoofdkwantumgetal n geeft de hoofdverdeling van de energieniveaus aan. Er zijn n (hoofd)schillen die elk een energieniveau vertegenwoordigen. Deze hoofdschillen (schalen) worden genummerd van 1 tot 7, van de kern naar buiten toe. Ook worden ze wel met de letters K, L, M, N, O, P, Q aangeduid. De aanduiding met letters wordt vooral nog gebruikt bij röntgenstraling, om aan te geven welke binnenschillen betrokken zijn bij de elektronische overgang die de straling veroorzaakt. In de scheikunde gebruikt men daarentegen louter de nummers 1 tot 7. Hogere nummers dan 7 zijn in principe mogelijk, maar worden in praktijk niet gevonden, aangezien het aantal scheikundige elementen beperkt is.
Toen de eerste schillen ontdekt werden was hun onderling verband niet geheel duidelijk, en de eerste schil werd met de middelste letter van het alfabet voorzien (M), zodat men nog beide kanten op kon. Pas later vonden de wetenschappers dat er verder 'links' van de K geen andere schillen meer waren, ofschoon er voor enige tijd nog wel aan 'J-straling' werd gedacht.
Het nevenkwantumgetal[bewerken | brontekst bewerken]
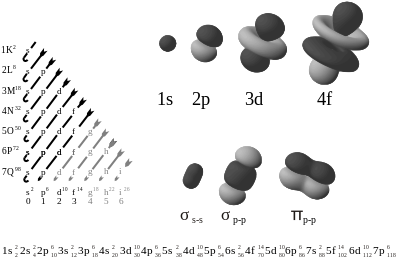
Elke elektronenschil bestaat uit een of meer subschillen (onderschillen). Elk van deze subschillen wordt aangeduid met een nevenkwantumgetal ℓ. Voor een hoofdkwantumgetal n kan ℓ de waarden 0, 1, 2, .., n-1 hebben. Er zijn dus n subschillen per hoofdschil. De subschillen worden ook wel aangegeven door een letter uit de reeks s, p, d, f, g, h, i, j, k,... toe te voegen aan het hoofdkwantumgetal n. Anders dan de hoofdkwantumletters, worden deze letters nog steeds veelvuldig in natuur- en scheikunde gebruikt. De eerste vier letters komen van de atoomspectra en staan voor scherp, principaal, diffuus, en fundamenteel, naar het uiterlijk van de spectraallijnen. Pas later werd hun onderling verband duidelijk en besloot men de reeks letters alfabetisch voort te zetten.Naast de voornoemde eerste drie kwantumgetallen zijn er nog andere, zoals het magnetisch spinkwantumgetal
Het magnetische kwantumgetal[bewerken | brontekst bewerken]
Het magnetische kwantumgetal m geeft aan in hoeveel banen iedere subschil verdeeld is; m loopt van -ℓ tot +ℓ, waarin ℓ het nevenkwantumgetal is. Er bestaan dan dus 2ℓ+1 van dergelijke banen per subschil.
Het magnetisch spinkwantumgetal[bewerken | brontekst bewerken]
Het magnetisch spinkwantumgetal s beschrijft, in tegenstelling tot de drie hoofdkwantumgetallen, niet zozeer de baan als wel de 'draaiing' van het elektron zelf. Dit getal kan twee waarden hebben: –½ en +½ (respectievelijk spin down en spin up).
De hier gegeven notatie voor de vier kwantumgetallen: n, ℓ, m, s wordt gebruikt in sommige boeken maar is niet geheel correct. De hier genoemde s heeft dezelfde eigenschappen voor de spin als m heeft voor de baan, namelijk het magnetisch kwantumgetal. Zorgvuldigere boeken gebruiken daarom n, ℓ, mℓ, ms, en voegen een vijfde nummer toe: s. Deze s (spinkwantumgetal) heeft dezelfde eigenschappen als ℓ. Maar aangezien, voor elektronen althans, deze s = ½ altijd, is het niet belangrijk voor verdere identificatie en kan het weggelaten worden.[bron?]
Twee elektronen moeten altijd minstens in een van hun kwantumgetallen verschillen vanwege het uitsluitingsprincipe van Pauli. In iedere baan kunnen zich daardoor twee elektronen bevinden, met tegengestelde spin.
Er komt steeds een subschil bij naarmate n hoger wordt: voor n = 1 is er één subschil (1s), voor n = 2 zijn er twee subschillen (2s en 2p), voor n = 3 zijn er drie (3s, 3p, 3d), enzovoorts. Dit is gebaseerd op het atoommodel van Sommerfeld.
| nummer en letter van schil (n) | nummer van subschil, maximaal n−1 (ℓ) | aantal banen (2 × ℓ + 1) | aantal elektronen in baan, 2 per baan | aantal elektronen per schil | |
|---|---|---|---|---|---|
| 1 | K | 0 | 1 | 2 | 2 |
| 2 | L | 0, 1 | 1, 3 | 2, 6 | 8 |
| 3 | M | 0, 1, 2 | 1, 3, 5 | 2, 6, 10 | 18 |
| 4 | N | 0, 1, 2, 3 | 1, 3, 5, 7 | 2, 6, 10, 14 | 32 |
| 5 | O | 0, 1, 2, 3, 4 | 1, 3, 5, 7, 9 | 2, 6, 10, 14, 18 | 32 (50) |
| 6 | P | 0, 1, 2, 3, 4, 5 | 1, 3, 5, 7, 9, 11 | 2, 6, 10, 14, 18, 22 | 32 (72) |
| 7 | Q | 0, 1, 2, 3, 4, 5, 6 | 1, 3, 5, 7, 9, 11, 13 | 2, 6, 10, 14, 18, 22, 26 | 32 (98) |
Omdat een schil nooit meer dan 32 elektronen kan hebben, zijn de laatste schillen enkel opgebouwd tot 32. Pas na het element met atoomnummer 120 zou de 5g-subschil gevuld gaan worden. Het zwaarste element tot nu toe (2023) is echter nummer 118: oganesson.
De elektronen in de schillen met lage n-waarde worden de binnenelektronen genoemd. De buitenste elektronen, de valentie-elektronen, zijn het meest bepalend voor de chemische eigenschappen van het atoom.
Golffunctie[bewerken | brontekst bewerken]
Het beeld dat in dit artikel geschetst wordt, dat de elektronen zich in (sub)schillen rond de atoomkernen bevinden is een benadering die men zich maakt van de zeer moeilijk te begrijpen beschrijving op grond van de theorie van de kwantummechanica. De elektronen hebben elk een waarschijnlijkheidsverdeling van de plaats waar ze zich werkelijk bevinden. Deze verdeling wordt beschreven met een golffunctie. Die golffunctie is niet zozeer een schil, maar heeft wel een bepaalde vorm. Het elektron heeft in feite een uitgestrekt gebied waar het zich kan bevinden (zie het waarschijnlijkheidsprincipe van Heisenberg). De vorm van de golffunctie is verschillend voor de aanduiding s, p, d enz. Door het uitsluitingsprincipe van Pauli kunnen geen elektronen naast elkaar bestaan met exact dezelfde golffunctie. Door de eigenschap spin van het elektron kunnen er wel twee elektronen zich bevinden in de subschil s. Namelijk het elektron met spin up en het andere elektron met spin down. Dit geldt voor iedere schil op het laagste niveau: de 'magnetische' subschil.
De schillen worden opgevuld met elektronen, naarmate het atoom zwaarder is (meer elektronen bevat). Hierbij wordt door de elektronen steeds de laagste energietoestand aangenomen. Hierdoor wordt meestal een dichter tegen de kern gelegen schil volledig opgevuld, voordat een elektron plaats neemt op een schil die verder van de kern gelegen is.
Voor elke rij elementen worden alleen de nieuwe schillen vermeld, alle schillen uit de bovenliggende rijen zijn geheel gevuld (denk er de elektronenconfiguraties van de meest rechtse elementen - de edelgassen - uit alle bovenliggende rijen bij).
Voorbeeld: de volledige elektronenconfiguratie van broom (symbool Br) is 1s22s22p63s23p64s23d104p5. Meestal worden de compleet gevulde schillen uit bovenliggende rijen van het systeem vervangen door het symbool van het edelgas uit de vorige rij. De elektronenconfiguratie van broom wordt dan aangegeven als [Ar] 4s23d104p5.
In onderstaande tabel wordt het aantal elektronen per subschil, per schil, en voor het volledige atoom gegeven. Dit is slechts een theoretisch maximumaantal elektronen, want voor de bekende elementen zijn niet alle subschillen volledig bezet.
- De eerste kolom is het kwantumgetal n: 1 tot 7.
- De tweede kolom is de oude benaming van de schil: K tot Q.
De vetgedrukte subschillen (7d, 7f, 7g, 7h, 7i en 6f, 6g, 6h en 5g) raken nooit vol in de grondtoestand omdat er maar 118 elementen zijn, voor zover bekend ten minste in 2022. Daardoor zullen de 5e, 6e en 7e schil nooit vol raken en zal het theoretisch maximum aantal elektronen voor het kwantumgetal n = 5, 6 en 7 nooit behaald worden. Daarom zijn deze waarden ook vet- weergegeven.
| n | Totaal aantal elektronen van het atoom | Elektronen van de schil | s | p | d | f | g | h | i | |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | K | 2 (1s) | 2 (1s) | 2 (1s) | ||||||
| 2 | L | 10 (1s2s2p) | 8 (2s2p) | 2 (2s) | 6 (2p) | |||||
| 3 | M | 28 (1s2s2p3s3p3d) | 18 (3s3p3d) | 2 (3s) | 6 (3p) | 10 (3d) | ||||
| 4 | N | 60 (1s2s2p3s3p3d4s4p4d4f) | 32 (4s4p4d4f) | 2 (4s) | 6 (4p) | 10 (4d) | 14 (4f) | |||
| 5 | O | 110 (1s2s2p3s3p3d4s4p4d4f5s5p5d5f5g) | 50 (5s5p5d5f5g) | 2 (5s) | 6 (5p) | 10 (5d) | 14 (5f) | 18 (5g) | ||
| 6 | P | 182 (1s2s2p3s3p3d4s4p4d4f5s5p5d5f5g6s6p6d6f6g6h) | 72 (6s6p6d6f6g6h) | 2 (6s) | 6 (6p) | 10 (6d) | 14 (6f) | 18 (6g) | 22 (6h) | |
| 7 | Q | 280 (1s2s2p3s3p3d4s4p4d4f5s5p5d5f5g6s6p6d6f6g6h7s7p7d7f7g7h7i) | 98 (7s7p7d7f7g7h7i) | 2 (7s) | 6 (7p) | 10 (7d) | 14 (7f) | 18 (7g) | 22 (7h) | 26 (7i) |
De volgorde waarin zij als functie van het atoomnummer opgevuld worden wijkt af, in die zin dat de 4s-elektronen eerder gevuld worden dan de 3d-elektronen. Hoewel de periodenummers van het periodiek systeem verband houden met het kwantumgetal n zijn ze daarom niet gelijk.
Dergelijke overkruisingen zijn het gevolg van steeds kleiner wordende energieverschillen tussen twee opeenvolgende hoofdschillen. Het laagste energienivau van een bepaalde hoofdschil kan dus energetisch gunstiger liggen dan het hoogste energieniveau van een voorafgaande hoofdschil.
De correcte opvulling kan men terugvinden met de diagonaalregel.
| 1s | |||
| 2s | 2p | ||
| 3s | 3p | 3d | |
| 4s | 4p | 4d | 4f |
| 5s | 5p | 5d | 5f |
| 6s | 6p | 6d | |
| 7s | 7p |
De tabel wordt gelezen beginnend met 1s, dan 2s, en daarna langs de diagonaal van rechtsboven naar linksonder beginnend bij 2s:
- 1s - 2s -
- 2p - 3s -
- 3p - 4s -
- 3d - 4p - 5s -
- 4d - 5p - 6s -
- 4f - 5d - 6p - 7s -
- 5f - 6d - 7p
En dan zijn er nog steeds hier en daar kleine onregelmatigheden.
Zie ook[bewerken | brontekst bewerken]
- Elektronenconfiguratie
- Golffunctie
- Periodiek Systeem/Elektronenconfiguratie
- Orbitaal, heeft ook grafische weergave van de elektronenbanen
