Bismut(III)fluoride
| Bismut(III)fluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
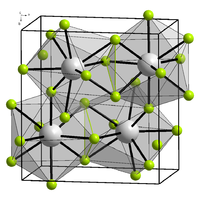
De kristalstructuur van lijkt heel erg op die van het hier afgebeelde
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Bismut(III)fluoride | |||
| Andere namen | Bismuttrifluoride | |||
| Molmassa | 265,9756 g/mol | |||
| SMILES | F-Bi(-F)-F
| |||
| CAS-nummer | 7787-61-3 | |||
| EG-nummer | 232-124-8 | |||
| PubChem | 82233 | |||
| Wikidata | Q425248 | |||
| Beschrijving | Grijs-wit poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 -P264 -P280 -P301+P330+P331 -P303+P361+P353 -P304+P340 -P305+P351+P338 -P310 -P321 -P363 -P405 -P501 | |||
| EG-Index-nummer | 232-124-8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | grijs-wit | |||
| Dichtheid | 5,32 g/cm³ | |||
| Smeltpunt | 649 °C[1] | |||
| Onoplosbaar in | Water[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Bismut(III)fluoride is een anorganische verbinding van bismut en fluor, met als brutoformule . De stof is een grijs-wit poeder en onoplosbaar in water. Het komt in de natuur voor als het zeldzame mineraal gananiet.
Synthese[bewerken | brontekst bewerken]
Bismut(III)fluoride wordt bereid uit bismut(III)oxide en waterstoffluoride volgens onderstaande reactie:
Structuur[bewerken | brontekst bewerken]
komt in verschillende polymorfen voor. α- heeft een cubische kristalstructuur. Het is het prototype voor de D03-structuur, die voorkomt bij verschillende inter-metaalverbindingen zoals , , en [3] en het hydride .[4] De eenheidscel is een vlak gecentreerde kubus met bismut op de hoekpunten en de centrale vlak posities. Fluor bevindt zich op het midden van de zijden en in het midden van de acht sub-kubussen. Dat levert 4 bismut- en 12 fluor-atomen op.[5] De lengte van de zijde van de eenheidscel is 585,3 pm.[4][6] Algemeen wordt de structuur als ionogeen beschouwd, dit in tegenstelling met de lichtere verbindingen uit deze groep, waarin ook in de vaste toestand nog duidelijk -eenheden herkenbaar zijn.[6]
Reacties[bewerken | brontekst bewerken]
wordt niet door water aangetast, maar is daar ook nauwelijks in oplosbaar. Complexen en adducten worden niet makkelijk gevormd, al zijn er wel aan paar bekend: en het ion is bekend uit . De additie-verbinding hydrolyseert in water tot bismutoxyfluoride .[7]
Toepassingen[bewerken | brontekst bewerken]
heeft in de research de aandacht getrokken als een mogelijk elektrodematriaal in Lithium-ion-accu
Bronnen, noten en/of referenties
|
















![{\displaystyle {\ce {( \ [BiO]F \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18179f42264183d23f53772b21e0fecca2f4374d)