Ethenon
| Ethenon | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
Structuurformule van ethenon
| ||||
| Algemeen | ||||
| Molecuulformule | C2H2O | |||
| IUPAC-naam | ethenon | |||
| Andere namen | keto-ethyleen, keteen, carbometheen | |||
| Molmassa | 42,03668 g/mol | |||
| SMILES | C=C=O
| |||
| InChI | 1S/C2H2O/c1-2-3/h1H2
| |||
| CAS-nummer | 463-51-4 | |||
| EG-nummer | 207-336-9 | |||
| PubChem | 10038 | |||
| Wikidata | Q421032 | |||
| Beschrijving | Kleurloos gas | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | (bij −60°C) 0,65 g/cm³ | |||
| Smeltpunt | −150 °C | |||
| Kookpunt | −56 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Ethenon is de eenvoudigste organische verbinding uit de stofklasse der ketenen en wordt zelf ook vaak keteen genoemd. Het is een kleurloos, ontvlambaar gas met een doordringende geur. De stof is iso-elektronisch met propadieen. Het koolstofatoom van de carbonylgroep is sp-gehybridiseerd.
Synthese[bewerken | brontekst bewerken]
Ethenon wordt gewoonlijk gevormd door de katalytische thermische ontleding (pyrolyse) van gasvormig azijnzuur met als katalysator een fosfaat, zoals tri-ethylfosfaat:[1]
Ethenon kan ook bekomen worden door de thermische ontleding van aceton.[2]
Door de thermische ontleding van diketeen bij 350 à 600 °C verkrijgt men zuiver ethenon, vrijwel zonder bijproducten.
Eigenschappen[bewerken | brontekst bewerken]
Ethenon is een onstabiele en reactieve verbinding, die gemakkelijk polymeriseert. Bij kamertemperatuur vormt het spontaan het dimeer diketeen; dat ontleedt bij verhitting weer tot ethenon. Met water reageert ethenon tot azijnzuur. De stof reageert ook hevig met vele organische verbindingen.
Ethenon kan niet opgeslagen of getransporteerd worden, maar moet na synthese onmiddellijk in situ ofwel verder gereageerd worden, ofwel gedimeriseerd worden tot diketeen, dat wel bewaard kan worden.
Blootstelling aan de stof kan irritatie veroorzaken van de ogen, de huid, of de luchtwegen en leiden tot longoedeem. In al deze organen komt veel water voor, waarmee keteen tot azijnzuur reageert. Zowel het onttrekken van water aan het weefsel als de lage zuurgraad van de ontstane azijnzuur-oplossing leiden tot weefselschade.
De blootstellingsgrenzen voor beroepsmatige blootstelling zijn 0,5 ppm (gelijk aan 0,86 mg/m3) als tijdgewogen gemiddelde (TWA) en 1,5 ppm of 2,6 mg/m3 voor kortstondige blootstelling (STEL).[3]
Toepassingen[bewerken | brontekst bewerken]
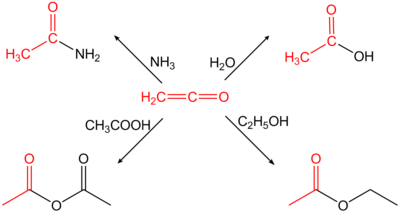
Ethenon is erg reactief vanwege de opeenvolging van dubbele bindingen in de structuur. Het wordt daarom veel gebruikt in organische synthese, met name als leverancier van een acetylgroep. Enkele reacties met ethenon zijn:
- met ammoniak tot aceetamide
- met water tot azijnzuur
- met ethanol tot ethylacetaat
- met azijnzuur tot azijnzuuranhydride
Een industrieel belangrijke reactie is die met azijnzuur tot azijnzuuranhydride, dat onder meer wordt gebruikt in de productie van celluloseacetaat en aspirine.
Ethenon is ook geschikt om cycloadditiereacties mee uit te voeren: de dimerisatie tot diketeen is daar een voorbeeld van. Een ander voorbeeld is de reactie met etheen tot cyclobutanon.[4]
Het dimeer diketeen is een belangrijk tussenproduct in de synthese van fijnchemicaliën voor pigmenten, geneesmiddelen en landbouwchemicaliën.