Hydroborering-oxidatie
De hydroborering-oxidatiereactie, ook wel oxidatieve hydroborering genoemd, is een organische reactie, bestaande uit twee stappen, die een alkeen omzet in een alcohol door de additie van water over de dubbele binding, met een boraan als elektrofiel. De hydroborering-oxidatiereactie is een anti-Markovnikov-reactie, waarbij de hydroxylgroep op het minst gesubstitueerde koolstofatoom van de dubbele binding wordt geplaatst.[1] De reactie werd ontdekt door Herbert Brown in de jaren '50 van de 20e eeuw en werd beloond met de Nobelprijs voor de Scheikunde in 1979. Ze wordt ook wel aangeduid als de Brown-hydroborering.
Een voorbeeld van deze reactie is de reactie van 2-methylpropeen tot 2-methylpropan-1-ol:

Hierin staat THF voor tetrahydrofuraan, het oplosmiddel waarop boraan stabiel bewaard kan worden.
Mechanisme van de hydroboreringreactie[bewerken | brontekst bewerken]
Belangrijk in de reactie is het gebruik van boraan, dat fungeert als elektrofiel in de reactie. De reden hiervoor is dat het booratoom in de molecule slechts zes elektronen in zijn buitenste schil heeft, terwijl acht het meest stabiel is (octetregel). Dit tekort maakt boraan een reactieve, instabiele molecule. Het komt dan ook doorgaans voor in de vorm van het dimeer diboraan, dat bestaat uit twee boraanmoleculen die door twee 3-center-2-elektronbindingen worden gekoppeld. Boraan kan ook worden gestabiliseerd door een elektronendonor (een lewisbase, doorgaans een ether) die een complex vormt met boraan (het lewiszuur).
Op hetzelfde voorbeeld als hierboven ziet de eerste stap van de reactie er als volgt uit:

De additie van boraan is een zogenaamde geconcerteerde reactie, wat betekent dat ze in één stap plaatsvindt. Er wordt dus geen vrij carbokation-intermediair gevormd. Het gevormde monoalkylboraan kan nog tweemaal verder reageren met een alkeen, waardoor een trialkylboraan gevormd wordt.
De reactie is zowel regioselectief als stereoselectief. De eerste eigenschap spruit voort uit de overgangstoestand van de reactie (middelste op figuur), deze heeft een partieel carbokation-karakter op het koolstofatoom waarop het booratoom zich niet bindt (ofwel dat waarop het waterstofatoom zich bindt). Dit komt doordat de binding tussen het booratoom (het elektrofiel) en koolstofatoom zich iets sneller vormt dan die tussen het waterstofatoom en het andere koolstofatoom. Omdat een (partieel) carbokation stabieler is naarmate het verbonden is met meer alkyl-substituenten (doordat de alkylgroepen elektronenstuwend zijn en door hyperconjugatie een gedeelte van de lading spreiden) zal de overgangstoestand met het booratoom op het minst gesubstitueerde koolstofatoom het makkelijkst en snelst gevormd worden. Netto komt de alcoholgroep (OH-groep) dus op het minst gesubstitueerde koolstofatoom. Hierdoor wordt de reactie omschreven als anti-Markovnikov, omdat de regel van Markovnikov voorspelt dat bij een vorming van een alcohol de hydroxylgroep op het meest gesubstitueerde koolstofatoom van de dubbele binding terechtkomt. Echter vervult bij de meeste addities van water het water de rol van nucleofiel, terwijl nu het boraan het elektrofiel is, en dan door water vervangen wordt.[2]
De reactie is ook stereoselectief, omdat de additie van boraan een syn-additie is, wat betekent dat het waterstofatoom en het booratoom langs dezelfde kant van de dubbele binding adderen. Als de reactie twee asymmetrische koolstofatomen vormt langs de voormalige dubbele binding zullen dus slechts twee van de maximaal vier mogelijke stereo-isomeren gevormd worden, meer bepaald een paar enantiomeren.[3]
De oxidatiereactie[bewerken | brontekst bewerken]
Het gevormde (tri)alkylboraan wordt in deze stap geoxideerd tot een alcohol met behulp van waterstofperoxide en een base, met water als oplosmiddel. Netto blijven de stereo- en regiochemie behouden. Het reactiemechanisme is als volgt (R stelt een willekeurige koolstofketen voor):
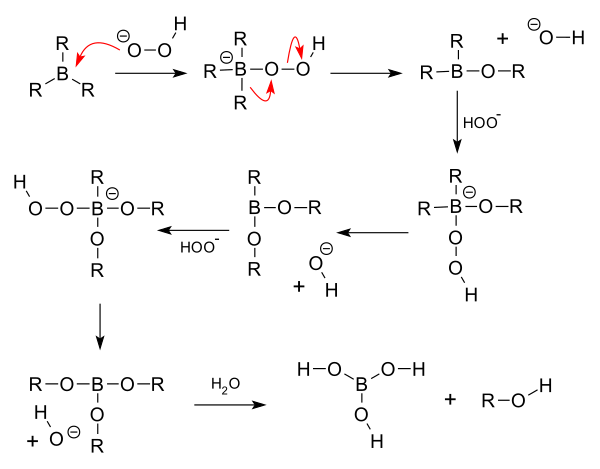
In de praktijk wordt het trialkylboraan omgezet in een trialkylboraat. Daarna worden drie alcoholmoleculen en een boraatmolecule gevormd.
Alkynen[bewerken | brontekst bewerken]
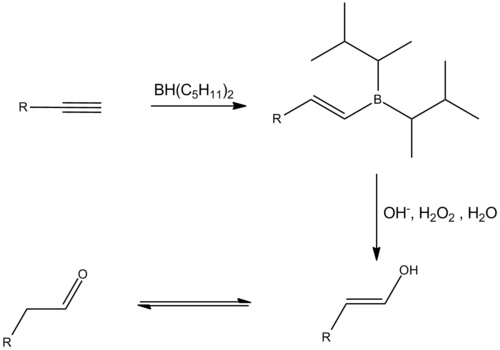
Het is ook mogelijk om een additie van water op een alkyn uit te voeren. Hierbij wordt initieel een enol gevormd, dat dan hoofdzakelijk tautomeriseert tot een keton of aldehyde (volgens de keto-enoltautomerie). Ook bij deze reactie wordt het meest gesubstitueerde enol preferentieel gevormd. Indien men van een eindstandig alkyn uiteindelijk een aldehyde wil vormen is ook hier een hydroborering-oxidatie mogelijk. Hierbij moet de additie van het boraan wel stoppen in het alkeen-stadium. Om die reden wordt daarvoor een sterk sterisch gehinderd boraan zoals disiamylboraan of 9-BBN gebruikt, zodat een tweede additie verhinderd wordt. Een daaropvolgende oxidatie vormt het enol, wat dan grotendeels tautomeriseert tot het aldehyde.[4]
Zie ook[bewerken | brontekst bewerken]
- Oxymercurering-reductie, die ook alcoholen uit alkenen vormt
Bronnen, noten en/of referenties
|
