Natriumtetrachloorauraat(III)
| Natriumtetrachloorauraat(III)[1] | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
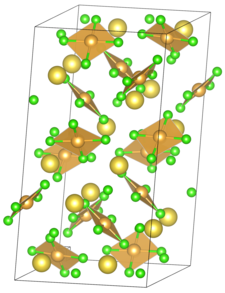
| ||||
__ Na+ __ Au3+ __ Cl−
| ||||
| Algemeen | ||||
| Molecuulformule | (watervrij) (dihydraat) | |||
| IUPAC-naam | Natriumterhloroauraat(III) Natriumterhloroauraat(III)dihydraat | |||
| Andere namen | Natrium-goudchloride Geel goudchloride | |||
| Molmassa | (watervrij) 361,8 g/mol (dihydraat)[2] 397,8 g/mol | |||
| SMILES | [Na+].Cl[Au-](Cl)(Cl)Cl
| |||
| CAS-nummer | 15189-51-2 (watervrij) 13874-02-7 (dihydraat) | |||
| EG-nummer | 628-726-9 | |||
| PubChem | 27127 | |||
| Wikidata | Q27122658 | |||
| Beschrijving | Oranje poeder (watervrij) Geel, kristallijn poeder[2] | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 - H314 - H317 - H318 - H412 | |||
| P-zinnen | P260 - P261 - P264 - P270 - P272 - P273 - P280 - P301+P312 - P301+P330+P331 - P302+P352 - P303+P361+P353 - P304+P340 - P305+P351+P338} - P310 - P321 - P330 - P333+P313 - P363 - P405 - P501 | |||
| EG-Index-nummer | 239-241-3 | |||
| LD50 (muizen) | 72 mg/kg | |||
| Fysische eigenschappen | ||||
| Dichtheid | [3] 3,81 g/cm³ | |||
| Smeltpunt | [2] 99-101 °C | |||
| Goed oplosbaar in | Water, ethanol[2] | |||
| Matig oplosbaar in | diethylether[4] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Natriumtetrachloorauraat(III) is een anorganische verbinding, een zout van natrium en het complexe -anion
Synthese[bewerken | brontekst bewerken]
De eerste synthese-route bestond uit het toevoegen van een oplossing van tetrachloorauraat(III)zuur aan natriumhydroxide of natriumcarbonaat. Het ontstane mengsel wordt verwarmd tot 100 °C en dan onder roeren ingedampt. Voordat al het water verdampt is wordt de oplossing gekoeld waarbij het product uitkristalliseert. Na drogen heeft men de oranje kristallijne stof in handen.[4][5]
Tegenwoordig wordt een efficientere methode gebruikt waarbij goud wordt toegevoegd aan een mengsel van een natrium-oxy-halogeenzout en waterstofchloride.[5]
Toepassingen[bewerken | brontekst bewerken]
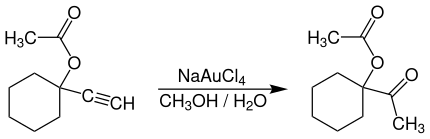
Na(AuCl4) is een niet-toxisch alternatief voor kwik als katalysator voor reacties met alkynen, bijvoorbeeld voor de aanmaak van geneesmiddelen. Voorbeeldreacties zijn de additie van waterstofchloride aan acetyleen, de oxidatie van sulfides[4] of de hydratie van terminale alkynen om methyl-ketonen te vormen:[6]
Na(AuCl4) is uitgangsstof voor andere goudverbindingen en complexen, zoals .[7]
Bronnen, noten en/of referenties
|








![{\displaystyle {\ce {[Au\{(HOH2C)2PC6H4P(CH2OH)2\}2]Cl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3bee1c36ab87651106dbd943229d2ae35d720e26)