Seleenhexafluoride
| Seleenhexafluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van seleenhexafluoride
| ||||
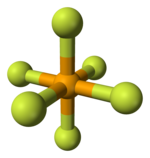
| ||||
Molecuulmodel van seleenhexafluoride
| ||||
| Algemeen | ||||
| Molecuulformule | SeF6 | |||
| IUPAC-naam | seleenhexafluoride | |||
| Andere namen | seleen(VI)fluoride | |||
| Molmassa | 192,950419 g/mol | |||
| SMILES | F[Se](F)(F)(F)(F)F
| |||
| CAS-nummer | 7783-79-1 | |||
| PubChem | 24558 | |||
| Wikidata | Q425217 | |||
| Beschrijving | Kleurloos gas | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Opslag | Brandveilig en koel opslaan. Verluchting langs de vloer. Gescheiden van voeding en voedingsmiddelen. | |||
| EG-Index-nummer | 034-002-00-8 | |||
| VN-nummer | 2194 | |||
| ADR-klasse | Gevarenklasse 2.3 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | 2,108 g/cm³ | |||
| Smeltpunt | −50,8 °C | |||
| Kookpunt | −34,5 °C | |||
| Onoplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | orthorombisch | |||
| Dipoolmoment | 0 D | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
1030 kJ/mol | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Seleenhexafluoride (SeF6) is een fluoride van seleen. De stof komt voor als een zeer toxisch kleurloos gas met een sterke geur, dat langzaam hydrolyseert in water. Het wordt meestal samengeperst tot een vloeistof, die ook zeer toxisch en corrosief is. Het gas sublimeert bij −46 °C.
De stof is qua structuur vergelijkbaar met zwavelhexafluoride. De lengte van de Se-F-binding bedraagt 168,8 pm.
Synthese[bewerken | brontekst bewerken]
Seleenhexafluoride kan bereid worden door een reactie van moleculair fluor en seleen:
Toepassingen[bewerken | brontekst bewerken]
Seleenhexafluoride wordt gebruikt om andere seleenhoudende verbindingen te maken en als gasvormige isolator.
Toxicologie en veiligheid[bewerken | brontekst bewerken]
De stof ontleedt bij verhitting, met vorming van giftige en corrosieve dampen, onder andere waterstoffluoride en seleen.
De stof is corrosief voor de ogen, de huid en de luchtwegen. Inademing van kan longoedeem veroorzaken. Snelle verdamping van de vloeistof kan bevriezing veroorzaken.

