Simmons-Smith-reactie
De Simmons-Smith-reactie of Simmons-Smith-cyclopropanatie is een cheletrope reactie, waarbij een carbeen reageert met een alkeen of alkyn ter vorming van een cyclopropaanring.[1][2] De bron voor het carbeen is doorgaans di-joodmethaan, dat in een inert oplosmiddel (veelal di-ethylether of dichloormethaan) in reactie wordt gebracht met een legering van zink en koper (het zogenaamd zink-koper-koppel):

De reactie werd vernoemd naar de Amerikaanse scheikundigen Howard Ensign Simmons, Jr. en Ronald D. Smith, die ze in 1958 publiceerden.[1] Het is voor de organische scheikundige een van de belangrijkste methoden voor de vorming van cyclopropaanringen.
Reactiemechanisme[bewerken | brontekst bewerken]
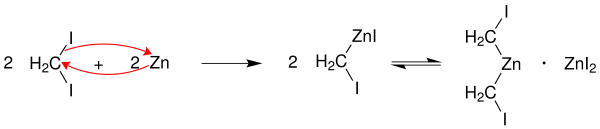
Het mechanisme van de Simmons-Smith-reactie verloopt via de insertie van een carbeen in de dubbele binding. De actieve component in de reactie is joodmethylzinkjodide (ICH2ZnI), een zinkcarbenoïde dat in een eerste stap gevormd wordt door reactie met geactiveerd zink (onder de vorm van een zink-koper-legering). Het gevormde joodmethylzinkjodide is wat betreft structuur erg vergelijkbaar met een Grignard-reagens en verkeert - afhankelijk van het gebruikte oplosmiddel - in een Schlenk-evenwicht met bis(jodomethyl)zink en zinkjodide:
In een volgende stap reageert joodmethylzinkjodide met het alkeen. Aangezien beide koolstof-koolstofbindingen via een geconcerteerd proces simultaan gevormd worden, wordt de configuratie aan de dubbele binding behouden en verloopt de reactie bijgevolg stereospecifiek:[3]

Alternatieve methoden[bewerken | brontekst bewerken]
De Simmons-Smith-reactie is tegenwoordig de meest toegepaste methode voor de vorming van cyclopropaanringen, hoewel de reactie vrij kostelijk is door het gebruik van di-joodmethaan. Een alternatieve methode is de Johnson-Corey-Chaykovski-reactie, waarbij een ylide reageert met een alfa,bèta-onverzadigde carbonylverbinding. Alternatieve reagentia voor di-joodmethaan zijn onder andere dibroommethaan[4] en diazomethaan met zinkjodide.[5] De reactiviteit van het reactiesysteem kan ook verhoogd worden door de zink-koper-legering te vervangen door di-ethylzink, dat echter door diens pyrofore karakter strengere eisen aan de veiligheid van de reactie stelt.[6]
Sterische effecten[bewerken | brontekst bewerken]
De Simmons-Smith-reactie is doorgaans gevoelig voor sterische effecten, waardoor de invoering van het methyleenfragment plaatsgrijpt aan de minder sterisch gehinderde zijde van het alkeen. Wanneer er zich echter een hydroxylgroep in de nabijheid van de dubbele binding bevindt, treedt coördinatie op met zink, waardoor de cyclopropaanring aan dezelfde zijde als de hydroxylgroep wordt ingevoerd. Deze zijde komt niet noodzakelijkerwijze overeen met de sterisch minder gehinderde zijde van het alkeen. Dit stereochemisch effect wordt ook wel aangeduid als het hydroxyleffect. Een voorbeeld van een dergelijke reactie is de omzetting van 2-cyclohexenol:[7]

Asymmetrische Simmons-Smith-reactie[bewerken | brontekst bewerken]
In 1992 werd een paper gepubliceerd betreffende de eerste asymmetrische Simmons-Smith-reactie. Daarbij werd cinnamylalcohol omgezet tot een chiraal cyclopropaanderivaat, waarbij gebruik werd gemaakt van een chiraal disulfonamide als ligand voor zink:[8]

De noodzakelijke vereiste voor het doorgaan van deze reactie is de aanwezigheid van de hydroxylgroep.
Bronnen, noten en/of referenties
|
