Bloedstolling: verschil tussen versies
| Regel 12: | Regel 12: | ||
De bloedplaatjes spelen een grote rol in het tijdelijk dichten van de beschadigde vaatwand. Onder normale omstandigheden klitten bloedplaatjes niet samen. Ook aan de gladde endotheelwand van het bloedvat hechten de bloedplaatjes onder normale omstandigheden niet. Normaal vormt het endotheel namelijk een barrière tegen onderliggende structuren die zorgen voor bloedplaatjesaggregatie (=binding). Ook produceren endotheelcellen stoffen die bloedplaatjesaggregatie tegengaan en hebben ze een verwijdende werking op de vaatwand. |
De bloedplaatjes spelen een grote rol in het tijdelijk dichten van de beschadigde vaatwand. Onder normale omstandigheden klitten bloedplaatjes niet samen. Ook aan de gladde endotheelwand van het bloedvat hechten de bloedplaatjes onder normale omstandigheden niet. Normaal vormt het endotheel namelijk een barrière tegen onderliggende structuren die zorgen voor bloedplaatjesaggregatie (=binding). Ook produceren endotheelcellen stoffen die bloedplaatjesaggregatie tegengaan en hebben ze een verwijdende werking op de vaatwand. |
||
Wanneer de vaatwand beschadigd raakt (zoals bij een wond) ontstaan onregelmatigheden in de vaatwand. Bloedplaatjes hechten zich vervolgens aan deze beschadiging. Dit wordt veroorzaakt door contact van de bloedplaatjes met de collageenvezels van de vaatwand (die door de beschadiging bloot komen te liggen). De hechting van de bloedplaatjes aan de collageenvezels vindt plaats onder invloed van de [[von willebrandfactor]] (VWF). Dit is een groot plasma-eiwit dat geproduceerd wordt door de endotheelcellen. Bloedplaatjes hechten via hun [[receptor (biochemie)|receptor]] (GP1b) aan de von willebrandfactor. Bloedplaatjes kunnen ook direct aan de beschadigde vaatwand binden, dit verloopt via glycoproteïnecomplexen (GP-Ia/IIa, GP-1b/IX en GP-IC/IIa). |
Wanneer de vaatwand beschadigd raakt (zoals bij een wond) ontstaan onregelmatigheden in de vaatwand. Bloedplaatjes hechten zich vervolgens aan deze beschadiging. Dit wordt veroorzaakt door contact van de bloedplaatjes met de collageenvezels van de vaatwand (die door de beschadiging bloot komen te liggen). De hechting van de bloedplaatjes aan de collageenvezels vindt plaats onder invloed van de [[von willebrandfactor]] (VWF). Dit is een groot plasma-eiwit dat geproduceerd wordt door de endotheelcellen. Bloedplaatjes hechten via hun [[receptor (biochemie)|receptor]] (GP1b) aan de von willebrandfactor. Bloedplaatjes kunnen ook direct aan de beschadigde vaatwand binden, dit verloopt via glycoproteïnecomplexen (GP-Ia/IIa, GP-1b/IX en GP-IC/IIa). |
||
Wanneer de bloedplaatjes aan collageen gehecht zijn worden ze geactiveerd door [[trombine]]. Hierdoor vallen de bloedplaatjes uit elkaar waardoor ze verscheidene stoffen vrijgeven. Zo komt [[serotonine]] vrij dat een potente vasoconstrictor is. Tevens wordt adenosinedifosfaat (ADP) vrijgegeven dat de propvorming versnelt. Vervolgens ontstaat een zichzelf versterkend proces waardoor nog meer bloedplaatjes aggregeren en wordt de propvorming versneld. Wanneer deze propvorming voltooid is, volgt het proces van de bloedstolling, waarbij de stollingsfactoren in een cascade geactiveerd worden (= coagulatie). |
Wanneer de bloedplaatjes aan collageen gehecht zijn worden ze geactiveerd door [[trombine]]. Hierdoor vallen de bloedplaatjes uit elkaar waardoor ze verscheidene stoffen vrijgeven. Zo komt [[serotonine]] vrij dat een potente vasoconstrictor is. Tevens wordt adenosinedifosfaat (ADP) vrijgegeven dat de propvorming versnelt. Vervolgens ontstaat een zichzelf versterkend proces waardoor nog meer bloedplaatjes aggregeren en wordt de propvorming versneld. Wanneer deze propvorming voltooid is, volgt het proces van de bloedstolling, waarbij de stollingsfactoren in een cascade geactiveerd worden (= coagulatie). |
||
=== Coagulatie === |
=== Coagulatie === |
||
Versie van 15 feb 2015 21:40
Bloedstolling of coagulatie[1] is het proces waardoor bloed dat aan de lucht of aan andere oppervlakken dan de binnenkant van het vaatstelsel wordt blootgesteld klontert en hard wordt. Het is één van de processen die bloedverlies bij verwondingen beperken (hemostase). Bloedstolling is een buitengewoon complex proces waarbij vooral de bloedplaatjes en een groot aantal eiwitten in het bloed, de zogenaamde stollingsfactoren, betrokken zijn. Falen van de bloedstolling leidt tot een verhoogde bloedingsneiging, terwijl het bij een verhoogde activiteit trombose kan veroorzaken.
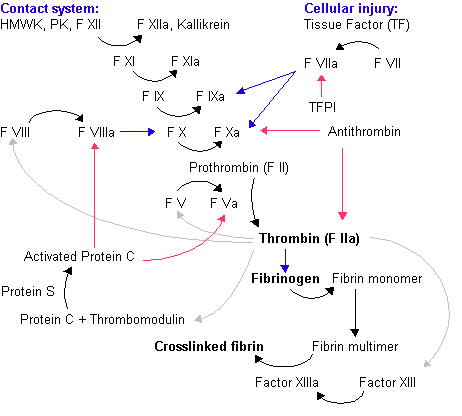
Twee manieren waarop de stollingscascade op gang kan worden gebracht zijn langs de zogeheten intrinsieke en de extrinsieke keten. Voor de intrinsieke keten zijn de componenten al in het bloed aanwezig. Bij de extrinsieke keten is nog tissue factor nodig dat wordt uitgescheiden door beschadigde cellen. In het lichaam vindt met name de extrinsieke route van bloedstolling plaats.
Fysiologie
Tijdens hemostase volgen drie stappen elkaar snel op. De eerste stap is vasoconstrictie, dit is het vernauwen van het beschadigde bloedvat. Vervolgens treedt propvorming op uitgaande van de bloedplaatjes. Als laatste stap vindt coagulatie plaats.
Vasoconstrictie
Meteen na beschadiging van een bloedvat treedt vasoconstrictie op. Dit vernauwen van het bloedvat kan wel tot 30 minuten na de beschadiging van het vat voortduren. Door dit proces wordt het bloedverlies beperkt gehouden. De vernauwing van het vat wordt veroorzaakt door een directe beschadiging van de celmembraan van de gladde spiercellen in de vaatwand. Hierdoor kunnen natriumionen de spiercel binnendringen en er op hun beurt voor zorgen dat deze samentrekt wat de diameter van het vat verkleint. Tevens wordt geopperd dat de vernauwing een reflexmatige reactie is ten gevolge van de activatie van lokale pijnreceptoren. De mate van vasoconstrictie is rechtstreeks afhankelijk van de hoeveelheid weefselbeschadiging. Bij een scherpe snee (met geringe weefselbeschadiging), zoals een scheerwond, vindt nauwelijks vasoconstrictie plaats.
Propvorming
De bloedplaatjes spelen een grote rol in het tijdelijk dichten van de beschadigde vaatwand. Onder normale omstandigheden klitten bloedplaatjes niet samen. Ook aan de gladde endotheelwand van het bloedvat hechten de bloedplaatjes onder normale omstandigheden niet. Normaal vormt het endotheel namelijk een barrière tegen onderliggende structuren die zorgen voor bloedplaatjesaggregatie (=binding). Ook produceren endotheelcellen stoffen die bloedplaatjesaggregatie tegengaan en hebben ze een verwijdende werking op de vaatwand. Wanneer de vaatwand beschadigd raakt (zoals bij een wond) ontstaan onregelmatigheden in de vaatwand. Bloedplaatjes hechten zich vervolgens aan deze beschadiging. Dit wordt veroorzaakt door contact van de bloedplaatjes met de collageenvezels van de vaatwand (die door de beschadiging bloot komen te liggen). De hechting van de bloedplaatjes aan de collageenvezels vindt plaats onder invloed van de von willebrandfactor (VWF). Dit is een groot plasma-eiwit dat geproduceerd wordt door de endotheelcellen. Bloedplaatjes hechten via hun receptor (GP1b) aan de von willebrandfactor. Bloedplaatjes kunnen ook direct aan de beschadigde vaatwand binden, dit verloopt via glycoproteïnecomplexen (GP-Ia/IIa, GP-1b/IX en GP-IC/IIa). Wanneer de bloedplaatjes aan collageen gehecht zijn worden ze geactiveerd door trombine. Hierdoor vallen de bloedplaatjes uit elkaar waardoor ze verscheidene stoffen vrijgeven. Zo komt serotonine vrij dat een potente vasoconstrictor is. Tevens wordt adenosinedifosfaat (ADP) vrijgegeven dat de propvorming versnelt. Vervolgens ontstaat een zichzelf versterkend proces waardoor nog meer bloedplaatjes aggregeren en wordt de propvorming versneld. Wanneer deze propvorming voltooid is, volgt het proces van de bloedstolling, waarbij de stollingsfactoren in een cascade geactiveerd worden (= coagulatie).
Coagulatie
Tijdens dit proces vermindert de vloeibaarheid van het bloed tot er uiteindelijk een stolsel gevormd wordt. Als eerste stap wordt de stof protrombineactivator gevormd. Deze stof zorgt ervoor dat protrombine, dat zich in het bloedplasma bevindt, omgevormd wordt tot het actieve trombine. Op zijn beurt katalyseert trombine de vorming van fibrinedraden uit fibrinogeen. Deze fibrinedraden dichten de vaatbeschadiging tot het vat definitief gerepareerd kan worden. Deze voorstelling is slechts zeer beperkt gehouden. In realiteit spelen er meer dan dertig substanties een rol bij bloedstolling. Stoffen die de bloedstolling stimuleren worden procoagulantia genoemd. Stoffen die de bloedstolling tegengaan worden anticoagulantia genoemd. Of het bloed al dan niet stolt hangt af van de balans tussen beide factoren. Onder normale omstandigheden helt de balans over naar de anticoagulantia zodat het bloed vloeibaar wordt gehouden. Hoe het hierboven geschetste proces plaatsvindt wordt onderstaand meer gedetailleerd besproken.
De stolling kan op twee manieren plaatsvinden:
- Intrinsiek: dit is een proces dat in het laboratorium waargenomen wordt en is daarmee een goede maat voor de functionaliteit van de stolling in het lichaam. In het lichaam heeft de intrinsieke route een versterkende werking op de extrinsieke route;
- Extrinsiek: hierbij wordt, onder invloed van weefselfactor dat uitgescheiden wordt door beschadigde cellen, de stolling geactiveerd. In het lichaam wordt de bloedstolling geïnitieerd door de extrinsieke route. De uitgescheiden weefselfactor noemt men Tissue Factor (TF), factor III of weefseltromboplastine.
Hieronder worden beide routes kort toegelicht. In de intrinsieke route start de stollingscascade bij Factor XII (FXII). Dit molecuul bindt aan negatief geladen oppervlaktes zoals kaoline, elaginezuur en dextraansulfaat. FXII wordt hierdoor geactiveerd tot FXIIa. FXIIa activeert vervolgens FXI tot FXIa. FXIa gaat vervolgens een complex aan met andere moleculen en dit complex activeert FIX tot FIXa. Factor IXa activeert in complex met FVIIIa, calcium en fosfolipiden, FX tot FXa. FXa activeert in complex met FVa, calcium en fosfolipiden, FII(protrombine) tot FIIA(trombine). Het trombine zet fibrinogeen om in fibrinemonomeren en deze monomeren polymeriseren tot een groot netwerk (het stolsel).
In de extrinsieke route komt Tissue Factor (TF) vrij uit de beschadigde endotheelcellen. TF bindt aan FVII en vormen samen een complex. Dit complex kan FX activeren tot FXa. FXa vormt samen met FVa, calcium en fosfolipiden een complex. Op dit punt komen de extrinsieke en intrinsieke route samen. Het FXa-FVa-calcium-fosfolipiden complex zet namelijk protrombine om in trombine. De route verloopt dan verder zoals beschreven onder de intrinsieke route.
Zowel de intrinsieke als de extrinsieke weg komen uiteindelijk uit bij FX. Vanaf hier vindt een gemeenschappelijk proces plaats waarbij FX met FV, calciumionen en fosfolipiden het protrombineactivator vormt. Deze stof katalyseert de omvorming van het inactieve protrombine naar het actieve trombine. Trombine zorgt er weer voor dat fibrinogeen omgezet kan worden naar fibrine. Fibrine-eiwitten plakken aan elkaar tot draden en hechten zich ook aan de wondranden. Dit vindt plaats mede doordat trombine voor de activatie van factor XIII (= fibrine stabiliserende factor) zorgt waardoor het geheel stevig samengekleefd wordt. Bloedcellen worden in dit netwerk gevangen. Vervolgens krimpt het fibrinenetwerk, waardoor de wondranden naar elkaar toegetrokken worden en de bloedcellen klem worden gezet. Dit samentrekken vindt plaats onder invloed van de contractiele eiwitten actine en myosine die aanwezig zijn in de bloedplaatjes (analoog aan het samentrekken van een spiercel, waar actine en myosine ook aanwezig zijn). Tijdens dit proces wordt de vaatwand verder gerepareerd door vrijgifte van de platelet-derived growth factor (PDGF) door de bloedplaatjes. Deze groeifactor zorgt voor verdere reparatie van de vaatwand.
Procoagulantia
| Nummer en/of naam | Functie |
|---|---|
| I (fibrinogeen) | Vormt klonter (fibrine) |
| II (protrombine) | De geactiveerde vorm (IIa) activeert I, V, VII, XIII, proteïne C, bloedplaatjes (vitamine K nodig voor aanmaak) |
| III (Tissue factor of weefsel tromboplastine) | Co-factor van VIIa |
| IV Calcium | Noodzakelijk voor de binding van stollingsfactoren met fosfolipiden |
| V (Proaccelerine of labile factor) | Co-factor van X met hetwelk het protrombinasecomplex vormt |
| VI (Accelerine) | Nummer wordt niet langer meer gebruikt. Gedacht wordt dat de stof dezelfde is als factor V |
| VII (Proconvertine of serum protrombine conversion accelerator -SPCA) | Activeert IX, X (vitamine K nodig voor aanmaak) |
| VIII (antihemofiele factor -AHF) | Co-factor van IX met welke het het tenasecomplex vormt |
| IX (plasma tromboplastinecomponent -PTC of christmasfactor) | Activeert X: vormt tenasecomplex met factor VIII (vitamine K nodig voor aanmaak) |
| X (stuart-prowerfactor of trombokinase) | Activeert II: vormt protrombinasecomplex met factor V (vitamine K nodig voor aanmaak) |
| XI (plasmatromboplastinantecedent -PTA) | Activeert XII, IX en prekallikrein |
| XII (Hageman factor) | Activeert prekallikrein en fibrinolyse |
| XIII (fibrine stabiliserende factor) | Hecht fibrinedraden stevig vast aan elkaar |
| von willebrandfactor | Bindt FVIII, zorgt voor plaatjesadhesie |
Remming van de stolling
De belangrijkste remmers van de stolling zijn antitrombine (AT), proteïne C en proteïne S. AT inactiveert trombine, maar is ook in staat om factoren Xa, XIIa, XIa, IXa, en IIa te remmen. Heparine zorgt voor een versnelde werking van antitrombine. Heparine wordt in het ziekenhuis veel gebruikt voor de behandeling van patiënten met trombose. Proteïne C breekt de factoren Va en VIIIa af, waardoor de stolling geremd wordt. Proteïne C heeft voor een optimale werking Proteïne S nodig (=cofactor). Voor laboratorium doeleinden kan EDTA of citraat gebruikt worden welke het calcium wegvangen waardoor het bloed onstolbaar is; hierdoor kan er in plasma gemeten worden in plaats van serum. Trombose diensten maken ook gebruik van stollingsremmende middelen, maar is op een ander systeem gebaseerd. Een aantal van de stollingsfactoren zijn afhankelijk van vitamine K voor hun aanmaak. Dit zijn de stollingsfactoren II, VII, IX en X. Bij een tekort aan vitamine K worden niet-functionele vormen, PIVKA's (protein induced by vitamin K absence or antagonist) gevormd. De functie kan afgeremd worden met behulp van een vitamine K-antagonist zoals bijvoorbeeld acenocoumarol, fenprocoumon en dergelijke. Daarnaast kan ook gebruikgemaakt worden van aspirine en aanverwante stoffen die nog een ander mechanisme volgen.
Fibrinolyse
Fibrinolyse is het proces waarbij het stolsel weer opgeruimd wordt. Om dit proces te starten wordt plasminogeen omgezet in plasmine door tPA, uPA of streptokinase (uit endotheelcellen). Plasmine lost het stolsel op door de fibrinedraden af te breken. Hierbij ontstaan fibrineafbraakfragmenten X, Y D (D-dimeer) en E.
Zie ook
Literatuurverwijzingen
- ↑ Everdingen, J.J.E. van, Eerenbeemt, A.M.M. van den (2012). Pinkhof Geneeskundig woordenboek (12de druk). Houten: Bohn Stafleu Van Loghum.
