Atoom
- Dit artikel gaat over atoom in de natuur- en scheikunde. Voor atoom in de logica zie atoom (logica).
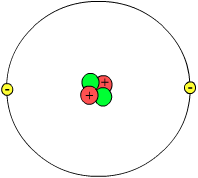
Een atoom is van ieder scheikundig element de kleinste nog als zodanig herkenbare bouwsteen.
Vrijwel alle scheikundige en natuurkundige eigenschappen van de op aarde voorkomende materie zijn gekoppeld aan de eigenschappen van atomen. Het is daarom een sleutelbegrip in deze beide wetenschappen. De eigenschappen van atomen als geheel worden bestudeerd in de atoomfysica.
In bijvoorbeeld sterren, neutronensterren en zwarte gaten komt echter ook materie voor die niet uit atomen is opgebouwd. De studie van deze -vanuit aards perspectief bijzondere- vormen van materie is het terrein van de plasmafysica en de astrofysica.
Bouw van het atoom
Een atoom bestaat uit een uiterst kleine, positief geladen atoomkern met een diameter van ongeveer 10-14 meter (10 femtometer) die is opgebouwd uit protonen en neutronen; met daaromheen een wolk van negatief geladen elektronen met een diameter in de orde van 10-10 meter (100 picometer). De elektronenwolk blijft rondom de kern zitten door de elektrische aantrekking tussen de positief geladen kern en de negatief geladen elektronen, kernbinding genoemd. Een sterk versimpeld beeld van een atoom is gegeven in de bovenstaande illustratie.
De studie van de atoomkern is het terrein van de kernfysica. Het is mogelijk de bouwstenen van de kern nog verder te splijten in nog kleinere subatomaire deeltjes. Dit is het terrein van de hoge-energiefysica.
De elektronenwolk

De grootte van een atoom wordt bepaald door de elektronenwolk. Afhankelijk van het atoomnummer varieert de straal van een atoom van circa 60 (helium) tot 275 (francium) pm. Sinds begin jaren 80 is dat groot genoeg om met behulp van atomic force microscopie (AFM) en scanning tunneling microscopie (STM) te visualiseren.
De elektronenwolk wordt het best beschreven als een kansverdeling, waarbij een elektron zich niet op een exact bepaalde plaats bevindt. Men kan slechts spreken van een bepaalde kans een elektron binnen een eindig volume aan te treffen. Elk elektron van het atoom heeft een andere kansverdeling, hetgeen beschreven wordt met de kwantummechanica. Deze kansverdelingen worden vaak "schillen" genoemd, omdat de elektronen met de hoogste energie zich over het algemeen verder van de kern, in de "buitenste schil", zullen bevinden.
De elektronen in de "buitenste schil" bepalen vooral de scheikundige eigenschappen van de atomen. Sommige natuurkundige eigenschappen (bijvoorbeeld de geleiding van een stof) worden ook door de buitenelektronen bepaald. Andere natuurkundige eigenschappen hebben echter meer met de binnenelektronen te maken, zoals het opwekken van röntgenstraling.
De kern
Veel natuurkundige eigenschappen (bijvoorbeeld de massa of het radioactief gedrag van het atoom) hebben niets met de elektronen te maken, daar speelt juist de atoomkern met zijn protonen en neutronen een grote rol.
De kern is bijzonder klein, ongeveer 10-14 meter (10 femtometer). Omdat elektronen in vergelijking met protonen en neutronen vrijwel geen massa hebben, bevindt vrijwel alle massa van een atoom zich in deze piepkleine kern. De protonen en neutronen worden bij elkaar gehouden door de sterke kernkracht. Het aantal protonen wordt het atoomnummer genoemd. Het bepaalt de chemische eigenschappen van het atoom. Het aantal neutronen is bijna altijd groter dan het aantal protonen. Atomen met een gelijk aantal protonen kunnen als gevolg van een verschillend aantal neutronen verschillen in massa. Ze worden isotopen genoemd. Deze isotopen zijn chemisch identiek, maar hun fysische eigenschappen kunnen verschillen.
Ionen
De elektromagnetische kracht houdt de elektronen rondom de kern. Bij een neutraal atoom is het aantal protonen gelijk aan het aantal elektronen. Wanneer een atoom een verschillend aantal protonen en elektronen bevat, en dus niet neutraal is, spreekt men van een ion. Ionen met een tekort aan elektronen worden kationen genoemd; ionen met overschot aan elektronen anionen.
Een ion is in principe instabiel als het los voorkomt; het zal proberen een elektron uit de omgeving aan te trekken, of een elektron proberen los te laten. Ionen met gelijke lading stoten elkaar af. Met tegengestelde lading trekken zij elkaar aan. Men treft daarom altijd tegengestelde ionen bij elkaar in de buurt zodat gemiddeld gesproken de materie weer neutraal is (wet van behoud van lading).
Ionen kunnen bij hoge temperaturen gevormd worden in een gas, men spreekt dan van een plasma. Bij lagere temperaturen worden ionen ook in oplossingen aangetroffen. Ionen van tegengestelde lading kunnen ook uit oplossing neerslaan en een vaste stof vormen die men uit ionen opgebouwd kan beschouwen.
Elementen
Atomen kunnen onderscheiden worden naar het aantal protonen in de kern. Dit aantal heet het atoomnummer. Een stof die bestaat uit atomen met hetzelfde atoomnummer heet een element. Er zijn anno 2004 meer dan 112 verschillende elementen bekend, waarvan een aantal echter niet op aarde voorkomen. De elementen worden gerangschikt in het periodiek systeem.
Isotopen
Het is mogelijk dat de atomen van een element niet hetzelfde aantal neutronen in de kern bezitten. Men spreekt dan van isotopen. Isotopen hebben dezelfde chemische maar andere fysische eigenschappen. Van vrijwel alle elementen is meer dan één isotoop bekend. Daarnaast is het mogelijk om met behulp van kernsplijting en kernfusie nieuwe atomen te produceren, maar deze zijn vaak instabiel en ondergaan radioactief verval.
Moleculen
Er zijn gassen die uit losse atomen bestaan, dit zijn voornamelijk de edelgassen, zoals argon, maar het geldt ook voor de damp van bijvoorbeeld kwik. Meerdere atomen kunnen zich echter ook organiseren in moleculen en veel gassen en dampen bestaan uit losse moleculen. Waterdamp bijvoorbeeld bestaat uit watermoleculen die zijn opgebouwd uit twee waterstofatomen en één zuurstofatoom.
Geschiedenis
In het oude Griekenland speculeerden filosofen al over atomen (zie atomisme). Een van de grootste vragen was of materie eindeloos deelbaar was in kleinere deeltjes of niet. Bekende filosofen als Plato dachten van wel. Democritus was het daar duidelijk niet mee eens. Hij stelde dat atomen eigenschappen zoals grootte, vorm en massa hadden. Alle andere eigenschappen die aan materie werden toegeschreven (zoals kleur of smaak) zouden worden veroorzaakt door interacties tussen atomen. De naam atoom die door Democritus is bedacht komt van het Griekse atomos, dat ondeelbaar betekent. Later zijn er nog vele atoomtheorieën opgesteld; deze waren niet alle even onomstreden, maar het heeft ruim 2000 jaar geduurd voordat het ondeelbare atoom toch deelbaar bleek te zijn. Het atoom heeft dan echter wel zijn typische eigenschappen verloren.
Wat het begrip ondeelbaar betreft, moeten we wel voor ogen houden dat in vroegere tijden de begrippenkaders anders waren, en wetenschap en religie niet zo onderscheiden waren als heden. De term individu betekent ook: niet deelbaar. Als we een individu in stukken hakken dan verliezen we de karakteristieke eigenheid van het individu. Indien we aannemen dat een hiërarchisch opgebouwd stelsel een eenheid is (bijvoorbeeld een atoom, molecule, cel, orgaan, plant, dier, mens} dan kunnen we over het interne organiserende leven van zo'n stoffelijk stelsel spreken als een soort geestelijk atoom, door sommigen ziel of geest genoemd. Het is aan te nemen dat Plato in onze tijd bij de splitsing van een atoom zou zeggen: "Zie je wel dat het atoom niet deelbaar is: het atoom als uitdrukking van zijn wezen is verloren gegaan door zijn splitsing."
Slechts enkele eeuwen geleden (1714) nog heeft Leibniz een soort atoomtheorie het licht doen zien: de zogenaamde monadelogie. Een monade is vergelijkbaar met een atoom, maar de theorie gaat veel verder dan de huidige opvattingen van een stoffelijk/energetisch atoom. Een monade is de kern, de wezenseenheid van elke materiële eenheid, of het nu een atoom is of een mens of welk ander georganiseerde hiërarchische eenheid van ook.
In 1808 publiceerde de Engelse wetenschapper John Dalton een nieuwe theorie:
- Elementen bestaan uit kleine deeltjes, atomen genaamd.
- Elk element wordt gekarakteriseerd door de massa van het atoom; atomen van hetzelfde element hebben dezelfde massa en atomen van verschillende elementen hebben een verschillende massa.
- Bij het ontstaan van nieuwe stoffen verandert alleen de manier waarop atomen met elkaar verbonden zijn; de atomen zelf veranderen niet.
Een belangrijke vraag waar Dalton geen antwoord op kon vinden, was waar atomen zelf uit bestaan. Aan het einde van de 19e eeuw voerden verschillende wetenschappers experimenten uit met kathodestraalbuizen en langzaam kwamen zij tot het besef dat er zich daarin negatief geladen subatomaire deeltjes bevonden. Joseph John Thomson was in 1897 een van de eersten die daarover publiceerden. Hij gaf de negatieve deeltjes de naam corpuscles. Later zouden zij bekend worden als elektronen. In 1906 kreeg Thomson een Nobelprijs voor zijn ontdekking.
Na de bekendwording van de elektronen bood zich een nieuw probleem aan: atomen waren neutraal en als elektronen negatief waren, zouden er zich in atomen ook nog positief geladen deeltjes moeten bevinden. In 1911 beschreef Ernest Rutherford hoe hij experimenten met goudfolie en α-deeltjes had uitgevoerd (zie: atoommodel van Rutherford) en daaruit concludeerde dat een atoom bestond uit een kleine massieve positief geladen kern met daaromheen de negatief geladen elektronen. Latere experimenten, uitgevoerd door Rutherford en anderen, toonden aan dat de atoomkern twee verschillende deeltjes bevatte: positieve protonen en neutrale neutronen.
In 1914 stelde de Deense wetenschapper Niels Bohr dat de elektronen rondcirkelden rondom de atoomkern en dat zij zich in bepaalde banen met eigen energieniveaus bevonden (zie: atoommodel van Bohr). Omdat er met het model van Bohr nog steeds een aantal zaken niet verklaard konden worden, kwam Erwin Schrödinger in 1926 met een kwantummechanisch model waarbij elektronen niet als deeltjes, maar als golfverschijnsel werden voorgesteld. Een jaar later kwam Werner Heisenberg met het onzekerheidsprincipe van Heisenberg, waarmee hij aangaf dat het inderdaad niet mogelijk was van een elektron de precieze plaats in een atoom aan te geven.
