tert-butylthiol
| Tert-butylthiol | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van
| ||||
| Algemeen | ||||
| Molecuulformule | C4H10S | |||
| IUPAC-naam | 2-methylpropane-2-thiol | |||
| Andere namen | t-BuSH, 2-methylpropane-2-thiol, 2-methyl-2-propanethiol, tert-butyl mercaptan, TBM | |||
| Molmassa | 90,187 g/mol | |||
| CAS-nummer | 75-66-1 | |||
| Wikidata | Q973473 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H225 - H318 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P280 - P305+P351+P338 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 0,80 g/cm³ | |||
| Smeltpunt | −0,50 °C | |||
| Kookpunt | 62 - 65 °C | |||
| Vlampunt | −26 °C | |||
| Dampdruk | 19.000 Pa | |||
| Onoplosbaar in | alcoholen | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Tertiair butylmercaptaan (TBM), ook bekend als tert-butylthiol, 2-methylpropaan-2-thiol, 2-methyl-2-propaanthiol, en t-BuSH, is een organische zwavelverbinding met de formule (CH3)3CSH. Het is een thiol en een uiterst ontvlambare kleurloze vloeistof met een kenmerkende geur, en wordt toegevoegd als geurstof aan bijvoorbeeld gas en gebruikt bij veel organische reacties.
Synthese[bewerken | brontekst bewerken]
Tertiair butylmercaptaan werd voor het eerst gesynthetiseerd in 1932 met de reactie van het Grignard reagens, t-BuMgCl, met zwavel onder de vorming van het overeenkomstige thiolaat, gevolgd door hydrolyse.[1] De reactie verloopt als volgt:
- t-BuMgCl + S → t-BuSMgCl
- t-BuSMgCl + H2O → t-BuSH + Mg(OH)Cl
Reacties[bewerken | brontekst bewerken]
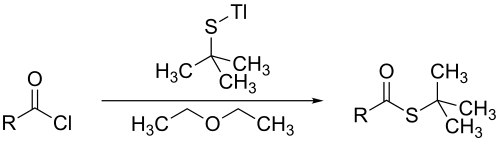
Tertiair butylmercaptaan kan reageren met metaalalkoxiden en acylchloriden onder vorming van thiolesters, zoals te zien is in de volgende vergelijking:[2]
In de bovengenoemde reactie gaat thallium(I)ethoxide over in thallium(I) t-butylthiolaat. Bij de aanwezigheid van di-ethylether reageert thallium(I) t-butylthiolaat met acylchloriden waarbij de overeenkomstige tert-butylthio-esters gevormd worden.[2] Net zoals andere thio-esters wordt het door hydrolyse weer omgevormd in tert-butylthiol.[3]
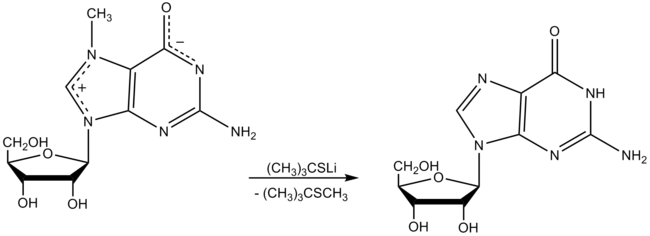
Lithium 2-methylpropaan-2-thiolaat kan geproduceerd worden door behandeling van tert-butylthiol met lithiumhydride in een geschikt oplosmiddel zoals hexamethylfosfortriamide (HMPT). Het gevormde thiolaatzout is een bruikbaar demethyleringsreagens. Bijvoorbeeld geeft behandeling met 7-methylguanosine guanosine. Andere N-gemethyleerde nucleosiden in tRNA zijn niet gedemethyleerd door dit reagens.[4]
Metaalcomplexen[bewerken | brontekst bewerken]
Het anion afkomstig van tert-butylthiol vormt complexen met verschillende metalen. Een voorbeeld is tetrakis(tert-butylthiolato)molybdeen(IV), Mo(t-BuS)4. Het complex werd verkregen door MoCl4 te behandelen met t-BuSLi:[5]
- MoCl4 + 4t-BuSLi → Mo(t-BuS)4 + 4LiCl
Mo(t-BuS)4 is een donkerrood diamagnetischcomplex dat gevoelig is voor lucht en vochtigheid. Het molybdeencentrum heeft een verwrongen tetrahedrale coördinatie met de vier zwavel atomen, met D2 symmetrie.[5]
Toxicologie en veiligheid[bewerken | brontekst bewerken]
De stof ontleedt bij verbranding, met vorming van giftige gassen, waaronder zwaveloxiden. De stof reageert met sterke zuren, sterke basen, metalen, sterk oxiderende stoffen en sterk reducerende stoffen, met vorming van zwaveloxiden.
Bronnen, noten en/of referenties
|