Succinaat-dehydrogenase


Het enzym succinaat-dehydrogenase (SDH) met de systematische naam ubichinon-oxidoreductase, ook complex II genoemd, is een enzymcomplex, dat uit vier subeenheden bestaat. Het heeft een massa van 140 kDa.
Succinaat-dehydrogenase is het enige membraangebonden eiwit dat deel uitmaakt van de citroenzuurcyclus en de ademhalingsketen en een tweede toegangspoort tot de oxidatieve fosforylering. Het katalyseert de stap waarbij succinaat wordt geoxideerd naar fumaraat. Daarbij worden twee protonen en twee energierijke elektronen overgedragen naar FAD, zodat FADH2 ontstaat. Via de ijzer-zwavelcentra in succinaat-dehydrogenase worden de elektronen van FADH2 overgedragen aan ubichinon/co-enzym Q. Ook hierbij wordt ubichinol gevormd, dat diffundeert naar complex III. In tegenstelling tot de complexen I, III en IV pompt complex II geen protonen naar de inter-membranaire ruimte (IMR) en draagt zo dus niet bij aan de productie van ATP.
De oxidatie van succinaat in fumaraat met FAD als oxidator:
met een gelijktijdig transport van twee elektronen over de membraangrens van het mitochondrion:
- 2e− (binnen) + FADH2 2e− (buiten) + FAD + 2H+
met behulp van deze elektronen wordt ubichinon (co-enzym Q10) in ubichinol gereduceerd:
- Q + 2H+ + 2e− QH2
Reactieketen[bewerken | brontekst bewerken]

Structuur[bewerken | brontekst bewerken]
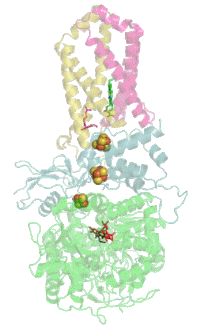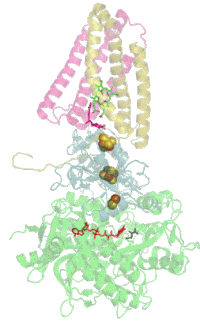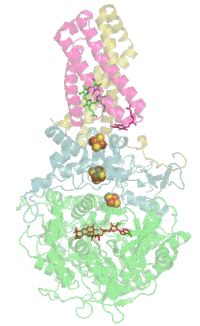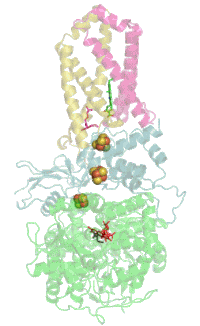
Evolutionair is het flavoproteïne de oudste subeenheid en homologe proteïnen komen daarom veel voor in bacteriën. Met de evolutie van de Eukaryoten kwam het ijzer-zwavel-proteïne erbij en met het erbij komende cytochroom van de Gewervelden werd het complex in het membraan verankerd.[1]
Mutaties in een van de vier coderende genen kunnen bij mensen een erfelijke stofwisselingsziekten veroorzaken (zie tabel).[2][3][4][5] Het proteïne bestaat bij mensen uit vier proteïnesubeenheden (zie tabel).
| Gen | Proteïne | Aantal aminozuren | UniProt[6] | OMIM[7] | Aandoening |
|---|---|---|---|---|---|
| SDHA | Flavoproteïne-subeenheid | 621 | P31040[8] | 600857[9] | Complex-II-deficiëntie |
| SDHB | IJzer-zwavel-proteïne-subeenheid | 252 | P21912[10] | 185470[11] | feochromocytoom, paraganglioom, Carney-Stratakis-syndroom |
| SDHC | Cytochroom-b560-subeenheid | 140 | Q99643[12] | 602413[13] | 4 Isovormen; paraganglioom, Carney-Stratakis-syndroom |
| SDHD | Cytochroom-b560-subeenheid | 103 | O14521[14] | 602960[15] | feochromocytoom, paraganglioom, Carney-Stratakis-syndroom, Syndroom van Leigh en darmkanker |

