Koolstofdioxide
| Koolstofdioxide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van koolstofdioxide
| ||||

| ||||
Molecuulmodel van koolstofdioxide
| ||||

| ||||
Pellets vast koolstofdioxide (droogijs) sublimeren bij kamertemperatuur
| ||||
| Algemeen | ||||
| Molecuulformule | CO2 | |||
| IUPAC-naam | koolstofdioxide | |||
| Andere namen | kooldioxide, koolzuurgas | |||
| Molmassa | 44,0095 g/mol | |||
| SMILES | C(=O)=O
| |||
| InChI | 1S/CO2/c2-1-3
| |||
| CAS-nummer | 124-38-9 | |||
| EG-nummer | 204-696-9 | |||
| PubChem | 280 | |||
| Wikidata | Q1997 | |||
| Beschrijving | Prikkelend kleurloos gas | |||
| Vergelijkbaar met | koolstofdisulfide | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P410+P403 | |||
| Opslag | Bij bewaring in een gasfles mag de temperatuur van de gasfles niet boven 50°C uitkomen. | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,98 × 10−3 g/cm³ | |||
| Sublimatiepunt | −78,5[1] °C | |||
| Dampdruk | (bij 20°C) 5,7258 × 106 Pa | |||
| Oplosbaarheid in water | 1,45 g/L | |||
| log(Pow) | 0,83 | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−393,5 kJ/mol | |||
| S |
213,8 J/mol·K | |||
| Nutritionele eigenschappen | ||||
| E-nummer | E290 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Koolstofdioxide, kooldioxide, ook koolzuurgas, in de 19e eeuw ook koolstofzuurgas genoemd, is een anorganische verbinding van koolstof en zuurstof, met als brutoformule CO2. In zuivere toestand is het een kleurloos en geurloos gas dat van nature in de aardatmosfeer voorkomt. De molecule bezit een lineaire geometrie en behoort tot de puntgroep D∞h.
Hoewel het gas zelf geurloos is, vormt het samen met waterdamp koolzuur, waardoor bij hogere concentraties een scherpe zure geur waargenomen kan worden. De eigenschappen van kooldioxide werden in de jaren 1750 bestudeerd door de Schotse wetenschapper Joseph Black.[2]
De atmosfeer van de Aarde bevatte in 2020 ongeveer 417 ppm koolstofdioxide.[3] Deze concentratie neemt verder toe.[4] Dit wordt veroorzaakt door menselijk handelen – voornamelijk door verbranding van fossiele brandstoffen – met klimaatverandering als gevolg. Het Intergovernmental Panel on Climate Change (IPCC) houdt zich intensief bezig met de oorzaken en gevolgen daarvan voor de opwarming van de aarde.
Enkele toepassingen[bewerken | brontekst bewerken]
Koolstofdioxide opgelost in water vormt koolzuur of diwaterstofcarbonaat (H2CO3). Soms wordt kooldioxide zelf – foutief – koolzuur genoemd (koolzuurgas zou correct zijn). Kooldioxide wordt veel gebruikt in frisdranken. Het toevoegen van koolstofdioxide onder druk aan dranken voor de prik, wordt carboniseren genoemd. In bier zit koolzuur na vergisting van de maltose uit mout. Het komt ook van nature voor in sommige mineraalwaters.
Koolstofdioxide wordt in sommige typen brandblussers gebruikt om vuur te bestrijden, met name indien water gevaarlijk zou zijn als blusmiddel, doordat het chemische reacties veroorzaakt, stroom geleidt of grote schade kan veroorzaken, zoals in papieren archieven.
Koolstofdioxide wordt gebruikt als een koudemiddel in koel- en vriesinstallaties. Het staat als koudemiddel bekend onder nummer R-744. Het gebruik van koolstofdioxide als koudemiddel is (opnieuw) in opkomst omdat het een veel lagere bijdrage aan de opwarming van het klimaat heeft dan de meeste synthetische koudemiddelen. Ook wordt koolstofdioxide, naast propaan (R-290), als koudemiddel ook gebruikt in warmtepompen voor minder goed te isoleren huizen waar een hogere radiatortemperatuur vereist is en met hun lage Global Warming Potential in het geval van lekkage tevens een geringere invloed heeft op opwarming van het klimaat. [5]
Ontdekking[bewerken | brontekst bewerken]
Koolstofdioxide werd ontdekt in het begin van de 17e eeuw door de Brusselaar Jan Baptista van Helmont, die het sylvestergas noemde. Hij stelde vast dat na verbranding van houtskool in een gesloten kom, de restmassa kleiner was dan de oorspronkelijke massa. Zijn conclusie was dat het verschil veranderd was in een wilde geest (toen spiritus sylvestre genoemd) of gas.
Chemische eigenschappen[bewerken | brontekst bewerken]
Koolstofdioxide bestaat uit een centraal koolstofatoom waaraan met dubbele bindingen twee zuurstofatomen zijn gebonden. Derhalve komt koolstof hier voor in zijn hoogste oxidatietoestand (+IV). Koolstofdioxide wordt gevormd bij de volledige verbranding van koolstof of koolstofhoudende verbindingen:
Bij onvolledige verbranding ontstaat koolstofmonoxide (CO), een toxisch en verstikkend gas dat aanleiding kan geven tot koolstofmonoxidevergiftiging.
Fysiologische eigenschappen[bewerken | brontekst bewerken]
Fotosynthese en cellulaire ademhaling[bewerken | brontekst bewerken]
Planten en andere autotrofe organismen gebruiken koolstofdioxide bij de fotosynthese. Bij deze chemische reactie worden water (H2O) en koolstofdioxide (CO2) opgenomen en in glucose omgezet, terwijl zuurstofgas (O2) wordt afgegeven. Voor dit proces is energie nodig, die wordt betrokken uit zonlicht. De zonne-energie wordt als chemische energie vastgelegd in de chemische verbinding glucose. De glucose wordt gebruikt als energiebron of omgezet in andere organische stoffen, bouwstoffen als cellulose en eiwitten, ten behoeve van groei en voortplanting. Zo komt de koolstof uit de kooldioxide via fotosynthese terecht in allerlei andere stoffen, deels zichtbaar, zoals cellulose en lignine in het hout van bomen.
In kassen wordt koolzuurgas als een soort bemesting van de planten gebruikt: bij aanwezigheid van meer koolstofdioxide groeien veel planten wat sneller. Ook bij een toename van het koolstofdioxidegehalte op Aarde kan de vegetatie sneller groeien.
Dieren doen het omgekeerde van wat planten doen: zij ademen zuurstof in voor de 'verbranding' van, uit verteerd voedsel afkomstige, voedingsstoffen. Bij de verbranding van deze vetten en koolhydraten in het lichaam wordt koolstofdioxide geproduceerd, die ze uitademen. De eerder door het zonlicht aan de planten geleverde energie komt tijdens de verbranding van deze voedingsstoffen weer vrij. Dit geldt ook voor de stofwisseling van schimmels.
De bovenstaande wisselwerking tussen planten en dieren, of nauwkeuriger gezegd autotrofe en heterotrofe organismen, vormt de kern van de koolstofkringloop.
Fysiologische eigenschappen bij zoogdieren[bewerken | brontekst bewerken]
Dierlijke cellen produceren koolstofdioxide als afvalproduct van de citroenzuurcyclus. Extra inspanning levert extra koolzuur, dat via het bloed wordt afgevoerd. De toename van koolzuur in het bloed verlaagt de pH (verhoogt de zuurgraad), die door het lichaam nauwkeurig tussen 7,35 en 7,45 wordt gehouden. Dreigt de pH te ver te dalen dan grijpt het ademhalingscentrum in de hersenen in door het versnellen en verdiepen van de ademhaling.
Fysische eigenschappen[bewerken | brontekst bewerken]
Twee fysische eigenschappen van koolstofdioxide komen in het dagelijks leven elk op hun eigen wijze naar voren. De meest prominente eigenschap is dat van broeikasgas. Daarnaast wordt koolstofdioxide vanwege de wijze waarop het van fase verandert, voor verschillende doeleinden gebruikt.
Broeikaseffect[bewerken | brontekst bewerken]
Doordat koolstofdioxide infrarode straling absorbeert, vermindert het de uitstraling naar de ruimte van zonnewarmte die de Aarde bereikt. Dit wordt het broeikaseffect genoemd, omdat in een kas een vergelijkbaar effect optreedt: kortegolfstraling kan naar binnen waar ze wordt omgezet in langegolfstraling, die niet meer kan ontsnappen.
Faseovergangen[bewerken | brontekst bewerken]
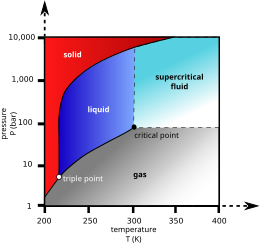
Bij afkoeling tot −78 °C gaat koolstofdioxide direct over (rijpt) in de vaste aggregatietoestand: droogijs of koolzuursneeuw genoemd. Vaste koolstofdioxide ziet er ongeveer uit zoals ijs gevormd uit water. Bij een normale luchtdruk smelt droogijs niet als het verwarmd wordt, maar het sublimeert (verdampt) direct terug naar de gastoestand. Pas boven een druk van 5,2 bar (de druk in het tripelpunt, zie ook de grafiek hiernaast) smelt droogijs bij −56 °C en komt het in de vloeibare fase zonder direct een gas te vormen. Als men bij 15 °C de druk verhoogt tot boven de 50 bar, wordt koolstofdioxide vloeibaar.
Er kunnen spectaculaire en toch relatief ongevaarlijke experimenten met vast koolstofdioxide gedaan worden. Als een paar korreltjes in een glas water worden gestrooid verdampt het droogijs door de relatieve warmte van het water. Het water gaat borrelen en er komt een flinke damp uit. Zo lijkt het of het water kookt, terwijl het gewoon op kamertemperatuur blijft of zelfs iets afkoelt. Doordat koolzuurdamp zwaarder is dan lucht loopt de damp vanuit het glas naar beneden. Dit effect wordt vaak op grotere schaal op toneel of televisie gebruikt in nevelmachines.
Droogijs wordt vaak gebruikt in combinatie met een bepaald oplosmiddel (zoals aceton of 2-propanol) om een koelbad te vormen voor de uitvoering van bepaalde experimenten in de organische synthese.
Geologische eigenschappen[bewerken | brontekst bewerken]
Koolzuur opgelost in (regen)water (diwaterstofcarbonaat en waterstofcarbonaat) is ook geologisch van belang, doordat het in staat is kalksteen op te lossen. Dit leidt tot karstverschijnselen. In de gebonden vorm als calciumcarbonaat (CaCO3) komt het voor als kalksteen (in Limburg mergel genoemd). Wanneer calciumcarbonaat wordt opgelost in zuur of wordt verhit zoals bij de productie van klinker en cement, komt koolstofdioxide weer vrij. De cementindustrie draagt voor ca. 5% bij aan de wereldwijde jaarlijkse uitstoot van het broeikasgas.
Voorkomen in de natuur en uitstoot door de mens[bewerken | brontekst bewerken]
Koolstofdioxide ontstaat bij diverse natuurlijke processen, onder andere bij savanne- en bosbranden, uitstoot door vulkanen, verteringsprocessen in natte oerwouden en mangroven, en komt vrij via CO2-uitwisseling met de zeeën en oceanen. De eenvoudigste manier om koolstofdioxide te produceren is echter de verbranding van koolstofhoudende stoffen, bijvoorbeeld houtskool en fossiele brandstoffen zoals aardolie en aardgas. Dit proces is voor de mensheid een van de belangrijkste energiebronnen. De menselijke/industriële CO2-uitstoot is volgens de huidige wetenschappelijke inzichten bijna 6% van de totale aardse CO2-uitwisseling.[6] Deze 6 procent moet door het systeem worden opgenomen om de concentratie CO2 constant te houden.

De belangrijkste processen om vrijgekomen koolstofdioxide weer uit de atmosfeer te verwijderen zijn CO2-opname door groene planten en opname door de oceanen. Omdat er geen netto toename van bossen op Aarde is draagt fotosynthese door groene planten alleen tijdelijk bij aan de verwijdering van koolstofdioxide uit de atmosfeer. De opnamesnelheid van koolstofdioxide in de oceanen is daarom bepalend voor de concentratieverandering. De opname gaat langzaam, omdat koolstofdioxide wel snel oplost in de bovenste lagen van de oceaan, maar er ook weer snel uit wordt afgegeven. Het transport naar diepere waterlagen waardoor koolstofdioxide uiteindelijk echt uit de kringloop zou verdwijnen duurt vele honderden jaren.[7]
Van de 6% koolstofdioxide (3,2 gigaton) die de mens toevoegt aan de natuurlijke kringloop door het verbranden van fossiele brandstoffen, wordt twee procentpunt gecompenseerd door permanente opname in de diepere waterlagen van de oceaan.[6] De overige vier procentpunt hebben sinds het begin van de industriële revolutie geleid tot een stijging van de CO2-concentratie van circa 280 ppm tot pieken boven 410 ppm in 2017.[8] In 2015 doorbrak de gemiddelde concentratie wereldwijd voor het eerst de grens van 400 ppm.[9]
CO2-metingen[bewerken | brontekst bewerken]
De bekendste metingen van het CO2-gehalte in de lucht zijn de data, afkomstig van het Mauna Loa Observatorium op Hawaï, gepubliceerd door de National Oceanic and Atmospheric Administration, een instelling van de Amerikaanse overheid. Uiteraard kunnen deze cijfers verschillen van de metingen, uitgevoerd elders op aarde. De cijfers van het allerlaatste jaar van meting zijn steeds voorlopig, in afwachting van kleine correcties.
| Jaar (historisch) |
ppm | Jaar[10] (21e eeuw) |
ppm | Jaar[10] (21e eeuw) |
ppm | ||
|---|---|---|---|---|---|---|---|
| 1750 | 277 | 2001 | 371 | 2016 | 404 | ||
| 1800 | 281 | 2002 | 373 | 2017 | 407 | ||
| 1850 | 284 | 2003 | 375 | 2018 | 409 | ||
| 1900 | 296 | 2004 | 377 | 2019 | 412 | ||
| 1950 | 313 | 2005 | 379 | 2020 | 414 | ||
| 1955 | 314 | 2006 | 381 | 2021 | 416 | ||
| 1960 | 317 | 2007 | 383 | 2022 | 419 | ||
| 1965 | 320 | 2008 | 385 | 2023 | 421[11] | ||
| 1970 | 325 | 2009 | 386 | ||||
| 1975 | 331 | 2010 | 389 | ||||
| 1980 | 339 | 2011 | 391 | ||||
| 1985 | 345 | 2012 | 393 | ||||
| 1990 | 354 | 2013 | 396 | ||||
| 1995 | 360 | 2014 | 398 | ||||
| 2000 | 369 | 2015 | 401 |
CO2-emissiehandel[bewerken | brontekst bewerken]
Om de uitstoot van het broeikasgas te reguleren is de CO2-emissiehandel[12] opgezet. Deelnemers aan de CO2-emissiehandel krijgen aan het begin van het jaar een bepaalde hoeveelheid rechten. Deze hoeveelheid is door de Nederlandse overheid (de ministeries van Economische Zaken en VROM) vastgesteld op basis van het nationale toewijzingsplan, ook wel het nationale allocatieplan of NAP genoemd. Een bedrijfslocatie waar emissie plaatsvindt beschikt over deze rechten als zij een geldige emissievergunning heeft. De registratie en de controle wordt in Nederland uitgevoerd door de Nederlandse Emissieautoriteit (NEA). Particulieren kunnen sinds 2010 via de CO2-markt[13] van Stichting Natuur en Milieu ook deze emissiehandel beïnvloeden door rechten op te kopen.
CO2-uitstoot van fossiele brandstoffen[bewerken | brontekst bewerken]
Vergelijking van de CO2-uitstoot bij 100% effectiviteit van de verbranding.
| materiaal | CO2 in kg/kWh[14] |
|---|---|
| Steenkool | 0,322 |
| Olie | 0,254 |
| Aardgas | 0,181 |
Bij verbranding van aardgas komt weliswaar veel minder CO2 vrij, maar het gebruik van aardgas is anderzijds erg vervuilend vanwege de methaanlekken bij de ontginning en het transport.[15]
CO2-uitstoot van transportmiddelen[bewerken | brontekst bewerken]
Vergelijking van de CO2-uitstoot van transportmiddelen per passagier per kilometer gemeten voor 2014.
| Middel | CO2 in g/km[16] |
|---|---|
| Trein | 28 |
| Bus | 56 |
| Tweewielers | 81 |
| Auto | 107 |
| Vliegtuig | 244 |
Toxicologie en veiligheid[bewerken | brontekst bewerken]
Hoewel koolstofdioxide in de atmosfeer voorkomt, is het in hogere concentraties giftig. In de omgeving van het Nyosmeer kwamen op 26 augustus 1986 meer dan 1700 mensen om toen uit het meer een grote hoeveelheid koolstofdioxide vrij kwam. Op 16 augustus 2008 moesten in Mönchengladbach 107 mensen worden opgenomen omdat uit een brandblusinstallatie 25 000 m3 koolstofdioxide[17] was vrijgekomen en een woonwijk was binnengestroomd.[18] Koolstofdioxide is zwaarder dan lucht en kan zich ophopen in grotten en (wijn)kelders. Een voorbeeld is de zogenaamde Hondsgrot bij Napels, waar de bodem bedekt is met een deken van kooldioxide. Mensen overleven een bezoek aan de grot, maar honden stikken direct, doordat ze zich met hun kop dichter bij de grond bevinden. De mogelijkheid van ontsnapping van grote hoeveelheden koolstofdioxide is een van de belangrijkste redenen van bezorgdheid bij ondergrondse opslag.
Koolstofdioxide heeft de volgende effecten op mensen, gemeten naar volumepercentage in lucht:
| 0,039% | koolstofdioxidegehalte in de atmosfeer op zeeniveau (rond 2011) |
| 0,15% | maximum toelaatbare koolstofdioxidegehalte binnenlucht klaslokaal (1500 ppm)[19] |
| 0,3% | MIC-waarde |
| 0,5% | MAC-waarde (langdurige maximaal aanvaardbare blootstelling zonder blijvende schade) |
| 1% | slecht geventileerde drukke (werk)ruimte. Sufheid bij langere blootstelling. |
| 1,5% | versnellen en verdiepen van de ademhaling. |
| 2% | licht narcotisch effect, toename van bloeddruk en polssnelheid, afname van het gehoor. |
| 4-5% | koolstofdioxidegehalte in uitgeademde lucht.[20] Veroorzaakt naast bovengenoemde effecten ook duizeligheid, verwarring en een gevoel van ademnood bij langere blootstelling. Uiteindelijk raakt men bewusteloos. Vanaf een concentratie van 5% kunnen ook paniekaanvallen voorkomen,[21] door de invloed van kooldioxide op de amygdala. |
| 8% | hoofdpijn, zweten, verlies van gezichtsvermogen en krampen. Bewusteloosheid na 5 tot 10 minuten, gevolgd door de dood na 30 minuten tot een uur. |
| 20% en hoger | bewusteloosheid na enkele ademteugen, snel gevolgd door ademstilstand. Dood na enkele minuten. |
Zie ook[bewerken | brontekst bewerken]
- CO2-toeslag BPM
- CO2-afvang en -opslag
- CO2-uitstoot en brandstofverbruik
- Koolstofkringloop
- Milieugevolgen van voedselproductie
Externe links[bewerken | brontekst bewerken]
 koolstofdioxide - International Chemical Safety Card
koolstofdioxide - International Chemical Safety Card- (en) Gegevens van koolstofdioxide in de GESTIS-stoffendatabank van het IFA
- Recent Global CO2 (Earth System Research Laboratory)


