Solvatatie
Solvateren wil zeggen dat een molecuul of ion van een opgeloste stof een aantal oplosmiddelmoleculen min of meer vast aan zich bindt. De buitenkant van deeltjes van de opgeloste stof gaan er dus uitzien alsof het eigenlijk ook gewoon alleen maar oplosmiddel is. De binding tussen opgeloste stof en oplosmiddel komt tot stand door:
Vanderwaalskrachten[bewerken | brontekst bewerken]
Deze krachten treden vooral op tussen verder apolaire moleculen zoals deze veel in de organische chemie worden aangetroffen. De krachten zijn zwak en niet aan een bepaald deel van het molecuul gebonden. Meestal wordt deze manier van oplossen niet tot de echte solvatatie gerekend.
Complexvorming[bewerken | brontekst bewerken]
Bij complexvorming kan het oplosmiddel zowel de rol van elektronendonor als die van elektronenacceptor vervullen.
Het oplosmiddel als elektronendonor[bewerken | brontekst bewerken]
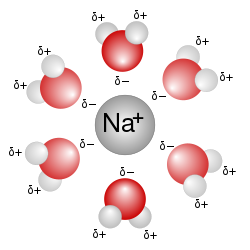
Het belangrijkste voorbeeld van deze vorm van solvatatie is water wanneer het gebruikt wordt als oplosmiddel voor zouten, zoals natriumchloride. De positieve natriumionen beschikken over onbezette orbitalen, waarmee de vrije elektronenparen op zuurstof in het watermolecuul een complex kunnen vormen. De buitenkant van het metaalion gaat daardoor op water lijken. Door de grotere effectieve straal van het ion (ion plus de moleculen in de watermantel) is de aantrekkingskracht op het chloride-ion een stuk kleiner geworden: F ~ (1/r2).
Coulombkrachten[bewerken | brontekst bewerken]
- Coulombkrachten zijn voornamelijk actief bij de solvatatie van de anionen van zouten. Deze ionen beschikken wel over negatieve lading, maar meestal niet op een manier die ze geschikt maakt om oplosmiddelmoleculen via een complex aan zich te binden. Vooral polaire oplosmiddelen beschikken vaak over een uitgesproken positief geladen kant in het molecuul (bij water de kant waar de twee waterstofatomen zitten). Deze positieve kant "plakt" aan het negatieve ion, waardoor dit ook een watermantel krijgt.
- Ook rond kationen kan coulombwerking optreden: vooral de kleine alkali-ionen Li+ en Na+ hebben hier last van. Naast de complex gebonden watermoleculen houden ze ook nog een aantal watermoleculen "vast" in een tweede laag. Deze tweede laag is niet meer aan het metaalion gebonden, maar de negatieve kant van de watermoleculen "plakt" wel aan het ingepakte, positieve metaalion.
Waterstofbruggen[bewerken | brontekst bewerken]
Vooral in de biochemie is solvatatie via waterstofbruggen een van de belangrijkste vormen van solvatatie. Met name suikers, zelf rijk aan -OH groepen, en eiwitten via de peptidebinding zijn daarin belangrijke voorbeelden.
Organische chemie[bewerken | brontekst bewerken]

In de organische chemie wordt bij een groot aantal reacties gebruikgemaakt van geladen intermediairen. Het gaat daarbij zowel om echte volledige ionen (bijvoorbeeld in de Wittig-reactie) als om partiële ionen zoals in de overgangstoestand van de hydroborering-oxidatie of in Grignardreacties. In de figuur hiernaast is het gesolvateerde molecuul methylmagnesiumchloride weergegeven. Het oplosmiddel is THF. De twee solvaterende moleculen vormen het bovenste deel van de figuur, het magnesium-atoom is het groene deeltje in het centrale deel van de figuur. Duidelijk is te zien dat de koppeling tussen de THF-moleculen en magnesium via de zuurstofatomen (rood) van THF verloopt.
Oplosmiddelen die deze ionen kunnen solvateren bevorderen de reactiesnelheid vaak positief.
Energie[bewerken | brontekst bewerken]
De vorming van de solvatatieschil levert energie. De energie-balans van een oplosreactie bestaat daarom uit een deel dat aan de reactie moet worden toegevoegd (om de binding tussen de moleculen of ionen van de op te lossen stof te verbreken) en de energie die vrijkomt als de solvatatiemantel wordt opgebouwd. Vooral bij het oplossen van natriumhydroxide of zwavelzuur is de laatste bijdrage duidelijk groter dan de eerste: de oplossingen worden heet (> 60 °C). Bij het oplossen van ammoniumchloride is de solvatatie duidelijk minder dan de bindingsenergie van het zout: de oplossing wordt kouder. Dat ammoniumchloride ondanks het feit dat het energie kost, heeft te maken met de toegenomen entropie van de oplossing ten opzichte van de vaste stof.
