Bamberger-omlegging
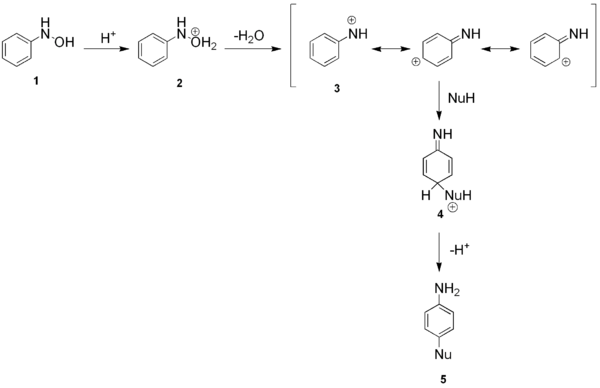
Bij de Bamberger-omlegging van N-fenylhydroxylamine en analoga in zuur midden ontstaat een 4-aminofenol. Deze reactie werd genoemd naar de Duitse chemicus Eugen Bamberger, die de reactie beschreef in 1894.[1]

Reactiemechanisme
[bewerken | brontekst bewerken]In zuur milieu zal het N-fenylhydroxylamine (1) geprotoneerd worden tot 2, hetwelke water zal elimineren ter vorming van arylnitreniumion 3. Voor dit laatste kunnen verschillende resonantievormen geschreven worden waarbij de positieve lading gedelocaliseerd wordt over de fenylring. Een nucleofiel (NuH) kan hierop aanvallen ter vorming van het instabiele intermediair 4, dat spontaan een proton zal verliezen om de aromaticiteit te herstellen met 5 als eindproduct. In het geval van 2,6-dimethylfenylhydroxylamine is men erin geslaagd het overeenkomstige intermediaire nitreniumion 3 te isoleren.[2]
Toepassingen
[bewerken | brontekst bewerken]Meestal wordt de Bamberger-omlegging geassocieerd met de spontane omlegging van N-fenylhydroxylamine in waterig zuur midden ter vorming van 4-aminofenol (7, met water als nucleofiel). Men kan echter ook andere nucleofielen gebruiken, bijvoorbeeld EtOH (p-fenetidine, 6) of vloeibare HF (p-fluoroaniline, 8). N-fenylhydroxylamine (1) zelf is een instabiel product en moet bereid worden vlak voordat men het wil gebruiken in een Bamberger-omlegging. Het kan relatief makkelijk gemaakt worden via reductie van nitrobenzeen met zink[3] of 5% Rh/C.[4] Er is eveneens een aanverwante reactie die verloopt via elektrochemische weg.[5]

Zie ook
[bewerken | brontekst bewerken]- Curtius-omlegging (nitreniumion intermediair)
- ↑ E Bamberger, Ber. deutsch. chem. Ges 27 (1894) p1347.
- ↑ M B Smith, J March. March's Advanced Organic Chemistry p878 (5th edition, 2001)
- ↑ Organic Syntheses Coll. Vol. 1 (1941) p445; Vol. 4 (1925) p57. (Artikel)
- ↑ Organic Syntheses Coll. Vol. 8 (1993) p16; Vol. 67 (1989) p187. (Artikel)
- ↑ Organic Syntheses Coll. Vol. 4 (1963) p148; Vol. 35 (1955) p22. (Artikel)
