Bismut(III)fluoride: verschil tussen versies
kGeen bewerkingssamenvatting |
kGeen bewerkingssamenvatting Labels: Magisch woord Link naar doorverwijspagina |
||
| Regel 1: | Regel 1: | ||
{{meebezig}} |
|||
{{Infobox chemische stof |
{{Infobox chemische stof |
||
| Naam = Bismut(III)fluoride |
| Naam = Bismut(III)fluoride |
||
| afbeelding1 = Kristallstruktur Yttrium(III)-fluorid.png |
| afbeelding1 = Kristallstruktur Yttrium(III)-fluorid.png |
||
| onderschrift1 = De kristalstructuur van <chem> |
| onderschrift1 = De kristalstructuur van <chem>BiF3</chem> lijkt heel erg op die van het hier afgebeelde <chem>YF3</chem> |
||
| afbeeldingbreedte1 = 200<!-- bij niet invullen wordt de totale breedte van de infoboxkolom gebruikt, de eenheid px wordt door het sjabloon bijgeplaatst. --> |
| afbeeldingbreedte1 = 200<!-- bij niet invullen wordt de totale breedte van de infoboxkolom gebruikt, de eenheid px wordt door het sjabloon bijgeplaatst. --> |
||
| afbeelding2 = |
| afbeelding2 = |
||
| onderschrift2 = |
| onderschrift2 = |
||
| afbeeldingbreedte2 = <!-- zie afbeeldingbreedte1 --> |
|||
| afbeelding3 = |
| afbeelding3 = |
||
| onderschrift3 = |
| onderschrift3 = |
||
| afbeeldingbreedte3 = <!-- zie afbeeldingbreedte1 --> |
|||
| afbeelding4 = |
| afbeelding4 = |
||
| onderschrift4 = |
| onderschrift4 = |
||
| Formule = |
| Formule = <chem>BiF3</chem> |
||
| Molgewicht = 265,9756 |
| Molgewicht = 265,9756 |
||
| SMILES = F-Bi(-F)-F |
| SMILES = F-Bi(-F)-F |
||
| InChI = |
| InChI = |
||
| IUPAC = Bismut(III)fluoride |
| IUPAC = Bismut(III)fluoride |
||
| AndereNamen = Bismuttrifluoride |
| AndereNamen = Bismuttrifluoride |
||
| CAS = 7787-61-3 |
| CAS = 7787-61-3 |
||
| EINECS = 232-124-8 |
| EINECS = 232-124-8 |
||
| ⚫ | |||
| ⚫ | |||
| PubChem = 82233 |
| PubChem = 82233 |
||
| Wikidata = |
|||
| Beschrijving = Grijs-wit poeder |
| Beschrijving = Grijs-wit poeder |
||
| Vergelijkbaar = |
| Vergelijkbaar = |
||
| AfbWaarsch = {{Pictogram GHS|C}} |
| AfbWaarsch = {{Pictogram GHS|C}} |
||
| TekstWaarsch = Gevaar |
| TekstWaarsch = Gevaar |
||
| ⚫ | |||
| ⚫ | |||
| Rzinnen = {{H314}} |
| Rzinnen = {{H314}} |
||
| EUHzinnen = ''geen'' |
| EUHzinnen = ''geen'' |
||
| Szinnen = {{P280}} - {{ |
| Szinnen = {{P260}} -{{P264}} -{{P280}} -{{P301+330+331}} -{{P303+361+353}} -{{P304+340}} -{{P305+351+338}} -{{P310}} -{{P321}} -{{P363}} -{{P405}} -{{P501}} |
||
| ⚫ | |||
| ⚫ | |||
| Omgang = |
| Omgang = |
||
| Opslag = |
| Opslag = |
||
| ⚫ | |||
| ⚫ | |||
| ADR = |
| ADR = |
||
| MAC = |
| MAC = |
||
| LethaalRat = |
| LethaalRat = |
||
| LethaalKonijn = |
| LethaalKonijn = |
||
| LethaalMuis = |
| LethaalMuis = |
||
| |
| LethaalKip = |
||
| Aggregatie = vast |
| Aggregatie = vast |
||
| Kleur = grijs-wit |
| Kleur = grijs-wit |
||
| Dichtheid = 5,32 |
| Dichtheid = 5,32 |
||
| Dichtheidref = |
|||
| Smeltpunt = 649 |
| Smeltpunt = 649 |
||
| Smeltpuntref = <ref name = "Greenwood">{{Greenwood&Earnshaw}}</ref> |
|||
| Kookpunt = |
| Kookpunt = |
||
| Sublimatiepunt = |
|||
| Vlampunt = |
| Vlampunt = |
||
| Zelfontbranding = |
| Zelfontbranding = |
||
| Dampdruk = |
| Dampdruk = |
||
| ⚫ | |||
| Oplosbaarheid = |
| Oplosbaarheid = |
||
| Oplosbaarheidtxt = |
|||
| GoedOplIn = |
| GoedOplIn = |
||
| MatigOplIn = |
| MatigOplIn = |
||
| SlechtOplIn = |
| SlechtOplIn = |
||
| OnoplIn = |
| OnoplIn = Water<ref name="alfa-aesar"/> |
||
| ⚫ | |||
| LogPow = |
| LogPow = |
||
| Viscositeit = |
| Viscositeit = |
||
| ⚫ | |||
| Kristalstructuur = |
| Kristalstructuur = |
||
| ⚫ | |||
| fG0g = |
| fG0g = |
||
| fG0l = |
| fG0l = |
||
| Regel 68: | Regel 76: | ||
| Evenwicht = |
| Evenwicht = |
||
| KlassiekeAnalyse = |
| KlassiekeAnalyse = |
||
| Spectra = |
| Spectra = |
||
| NutrientType = |
| NutrientType = |
||
| Essentieel = |
| Essentieel = |
||
| Regel 77: | Regel 85: | ||
}} |
}} |
||
__TOC__ |
|||
'''Bismut(III)fluoride''' is een [[ |
'''Bismut(III)fluoride''' is een [[anorganische verbinding]] van [[bismut]] en [[Fluor (element)|fluor]], met als [[brutoformule]] <chemn>BiF3</cherm>. De stof is een grijs-wit poeder en onoplosbaar in [[water]]. Het komt in de natuur voor als het zeldzame [[mineraal]] [[gananiet]]. |
||
== Synthese == |
== Synthese == |
||
Bismut(III)fluoride wordt bereid uit [[bismut(III)oxide]] volgens onderstaande reactie: |
Bismut(III)fluoride wordt bereid uit [[bismut(III)oxide]] en [[waterstoffluoride]] volgens onderstaande reactie: |
||
| ⚫ | |||
== Structuur == |
|||
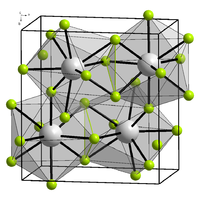
<chem>BiF3</chem> komt in verschillende [[isomorf]]en voor. α-<chem>BiF3</chem> heeft een cubische kristalstructuur. Het is het prototype voor de D0<sub>3</sub>-structuur, die voorkomt bij verschillende inter-metaalverbindingen zoals <chem>Mg3Pr</chem>, <chem>Cu3Sb</chem>, <chem>Fe3Si</chem> en <chem>Al3Fe</chem> <ref>{{citation|at = A1-2, A1-11| chapter = Appendix 1. Crystal Structure Descriptions| title = The Structure of Materials | publisher = Cambridge University Press | editor-first = Marc | editor-last = De Graef | editor-first2 = Michael |editor-last2 = McHenry}}</ref> as well as by the hydride LaH<sub>3.0</sub>.<ref name=galasso/> De eenheidscel is een [[Kubisch kristalstelsel|vlak gecentreerde kubus]] met bismut op de hoekpunten en de centrale vlak posities. Fluor bevindt zich op het midden van de zijden en in het midden van de acht sub-kubussen. Dat levert 4 bismut- en 12 fluor-atomen op.<ref>{{citation| title = Fundamentals of the Physics of Solids: Volume 1: Structure and Dynamics| first = Jenö |last = Sólyom| page = 220 | year = 2007|isbn = 978-3-540-72599-2 }}</ref> De lengte van de zijde van de eenheidscel is 585,3 [[Picometer|pm]].<ref name=galasso>{{citation| title = Structure and Properties of Inorganic Solids: International Series of Monographs in Solid State Physics | first = Francis S. |last = Galasso | publisher = Pergammon Press | year =1970 |at = 3.5. BiF<sub>3</sub>, DO<sub>3</sub>, Fm3m, Cubic. pp. 50–51 }}</ref><ref name = "Wells">Wells A.F. (1984) ''Structural Inorganic Chemistry'' 5th edition Oxford Science Publications {{ISBN|0-19-855370-6}}</ref> Algemeen wordt de structuur als ionogeen beschouwd, dit in tegenstelling met de lichtere <chem>EF3 \ (E \ = \ P, \ As, \ Sb)</chem> verbindingen uit deze groep, waarin ook in de vaste toestand nog duidelijk <chem>EF3</chem>-eenheden herkenbaar zijn.<ref name = "Wells"/> |
|||
== Reacties == |
|||
<chem>BiF3</chem> wordt niet door water aangetast, maar is daar ook nauwelijks in oplosbaar. |
|||
Complexen en adducten worden niet makkelijk gevormd, al zij er wel aan paar bekend: <chem>BiF.3HF</chem> en <chem>BiF<sub>4^{−}</chem> is bekend uit <chem>NH4BiF4</chem>. De additie-verbinding <chem>BiF3.3HF</chem> hydrolyseert in water tot [[oxidobismuthfluoride|bismutylfluoride]] <chem>( \ [BiO]F \ )</chem>.<ref>{{cite book|url=https://books.google.com/books?id=vVhpurkfeN4C&pg=PA50|pages=88|title=Chemistry of arsenic, antimony, and bismuth|isbn=978-0-7514-0389-3|author=Norman, Nicholas C|year=1998|publisher=Springer }}</ref> |
|||
== Toepassingen == |
|||
| ⚫ | |||
<chem>BiF3</chem> heeft in de research de aandacht getrokken als een mogelijk elektrodematriaal in [[Lithium-ion-accu]]<!-- |
|||
BiF<sub>3</sub> has received research attention as a possible electrode material for lithium batteries and as a luminescence host material for lanthanum-doped phosphors.<ref>{{Cite journal|last1=Xie|first1=Zhi|last2=Wei|first2=Bin|last3=Wang|first3=Zhongchang|date=2018-06-01|title=Structural stability, electronic structures and enhanced photocatalytic properties of BiF3 nanowires: A first-principles study|url=https://www.sciencedirect.com/science/article/pii/S0272884218305066|journal=Ceramics International|language=en|volume=44|issue=8|pages=9623–9632|doi=10.1016/j.ceramint.2018.02.189|s2cid=139879224 |issn=0272-8842}}</ref> |
|||
--> |
|||
{{Appendix|2= |
{{Appendix|2= |
||
{{Bronvermelding anderstalige Wikipedia|taal=en|titel=Bismuth trifluoride |oldid=1176703688 |datum=20240213}} |
{{Bronvermelding anderstalige Wikipedia|taal=en|titel=Bismuth trifluoride |oldid=1176703688 |datum=20240213}} |
||
Versie van 14 feb 2024 00:59
Aan dit artikel of deze sectie wordt de komende uren of dagen nog druk gewerkt.
Klik op geschiedenis voor de laatste ontwikkelingen.
| Bismut(III)fluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
De kristalstructuur van lijkt heel erg op die van het hier afgebeelde
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Bismut(III)fluoride | |||
| Andere namen | Bismuttrifluoride | |||
| Molmassa | 265,9756 g/mol | |||
| SMILES | F-Bi(-F)-F
| |||
| CAS-nummer | 7787-61-3 | |||
| EG-nummer | 232-124-8 | |||
| PubChem | 82233 | |||
| Wikidata | Q425248 | |||
| Beschrijving | Grijs-wit poeder | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 -P264 -P280 -Sjabloon:P301+330+331 -Sjabloon:P303+361+353 -Sjabloon:P304+340 -Sjabloon:P305+351+338 -P310 -P321 -P363 -P405 -P501 | |||
| EG-Index-nummer | 232-124-8 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | grijs-wit | |||
| Dichtheid | 5,32 g/cm³ | |||
| Smeltpunt | 649 °C[1] | |||
| Onoplosbaar in | Water[2] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Bismut(III)fluoride is een anorganische verbinding van bismut en fluor, met als brutoformule <chemn>BiF3</cherm>. De stof is een grijs-wit poeder en onoplosbaar in water. Het komt in de natuur voor als het zeldzame mineraal gananiet.
Synthese
Bismut(III)fluoride wordt bereid uit bismut(III)oxide en waterstoffluoride volgens onderstaande reactie:
Structuur
komt in verschillende isomorfen voor. α- heeft een cubische kristalstructuur. Het is het prototype voor de D03-structuur, die voorkomt bij verschillende inter-metaalverbindingen zoals , , en [3] as well as by the hydride LaH3.0.[4] De eenheidscel is een vlak gecentreerde kubus met bismut op de hoekpunten en de centrale vlak posities. Fluor bevindt zich op het midden van de zijden en in het midden van de acht sub-kubussen. Dat levert 4 bismut- en 12 fluor-atomen op.[5] De lengte van de zijde van de eenheidscel is 585,3 pm.[4][6] Algemeen wordt de structuur als ionogeen beschouwd, dit in tegenstelling met de lichtere verbindingen uit deze groep, waarin ook in de vaste toestand nog duidelijk -eenheden herkenbaar zijn.[6]
Reacties
wordt niet door water aangetast, maar is daar ook nauwelijks in oplosbaar. Complexen en adducten worden niet makkelijk gevormd, al zij er wel aan paar bekend: en Fout bij het parsen (Syntactische fout in formule): {\displaystyle \ce{BiF<sub>4^{−}}} is bekend uit . De additie-verbinding hydrolyseert in water tot bismutylfluoride .[7]
Toepassingen
heeft in de research de aandacht getrokken als een mogelijk elektrodematriaal in Lithium-ion-accu
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Bismuth trifluoride op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
- ↑ Sjabloon:Greenwood&Earnshaw
- ↑ Citefout: Onjuist label
<ref>; er is geen tekst opgegeven voor referenties met de naamalfa-aesar - ↑ De Graef, Marc; McHenry, Michael (reds.), "Appendix 1. Crystal Structure Descriptions", The Structure of Materials, Cambridge University Press, A1-2, A1-11
- ↑ a b Galasso, Francis S. (1970), Structure and Properties of Inorganic Solids: International Series of Monographs in Solid State Physics, Pergammon Press, 3.5. BiF3, DO3, Fm3m, Cubic. pp. 50–51
- ↑ Sólyom, Jenö (2007), Fundamentals of the Physics of Solids: Volume 1: Structure and Dynamics, p. 220, ISBN 978-3-540-72599-2
- ↑ a b Wells A.F. (1984) Structural Inorganic Chemistry 5th edition Oxford Science Publications ISBN 0-19-855370-6
- ↑ Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth. Springer, pp. 88. ISBN 978-0-7514-0389-3.














![{\displaystyle {\ce {( \ [BiO]F \ )}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18179f42264183d23f53772b21e0fecca2f4374d)