Humulon
| Humulon | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van (R)-humulon
| ||||
| Algemeen | ||||
| Molecuulformule | C21H30O5 | |||
| IUPAC-naam | (6R)-3,5,6-trihydroxy-2-(3-methylbutanoyl)-4,6-bis(3-methylbut-2-en-1-yl)cyclohexa-2,4-dien-1-on | |||
| Andere namen | α-lupulzuur, α-bitterzuur | |||
| SMILES | O=C(\C1=C(/O)\C(=C(\O)[C@@](O)(C1=O)C\C=C(/C)C)C\C=C(/C)C)CC(C)C
| |||
| CAS-nummer | 26472-41-3 | |||
| PubChem | 442911 | |||
| Wikidata | Q419456 | |||
| ||||
Humulon, ook bekend onder de naam α-lupulzuur, is een bitter smakende organische verbinding die voorkomt in de zaadbellen van rijpe hop (Humulus lupulus).[1]
Humulon is een van de belangrijkere componenten die bekend zijn onder de verzamelnaam alfazuren. Deze verbindingen zijn gezamenlijk verantwoordelijk voor de bittere smaak van bier.
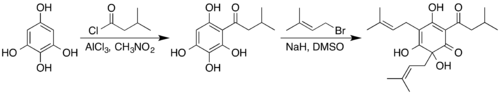
Synthese
[bewerken | brontekst bewerken]Hoewel humulon een natuurproduct is, kan het ook in het laboratorium gesynthetiseerd worden. De synthese start met 1,2,3,5-tetrahydroxybenzeen, dat via een Friedel-Craftsacylering (i) met isovaleroylchloride reageert tot 2,3,4,6-tetrahydroxyisovalerofenon. Na deze stap volgt reactie (ii) met prenylbromide (1-broom-3-methyl-2-buteen) waarbij humulon ontstaat.[2]
Structuur en eigenschappen
[bewerken | brontekst bewerken]Chemisch gezien is humulon een derivaat van floroglucinol met drie isopreen-zijketens. In twee van de zijketens is een dubbele binding aanwezig, de derde zijketen is verzadigd.
Net als ascorbinezuur vertoont humulon het onverwachte verschijnsel van een hydroxylgroep die rechtstreeks op een dubbele binding gekoppeld is. Het keto-enol-evenwicht is hier dus verschoven naar de enolvorm. De doorlopende conjugatie in het onverzadigde systeem en de mogelijkheid tot vorming van een interne waterstofbrug liggen hieraan ten grondslag. Hiermee is het systeem vergelijkbaar met β-diketonen, -zuren en esters.
Isohumulon
[bewerken | brontekst bewerken]Onder invloed van de thermische omstandigheden tijdens het brouwproces (een kokende waterige oplossing) ondergaat humulon een omlegging naar cis- en trans-isohumulon. In cis-isohumulon (middelste structuur hieronder) bevinden de hydroxylgroep en de iso-pentenylgroep zich aan dezelfde (achter)zijde van de vijfring, in het trans-isomeer (rechter structuur hieronder) bevindt de iso-pentenylgroep zich nog steeds aan de achterzijde, de hydroxylgroep is naar de voorzijde van de vijfring verplaatst:
Deze stoffen worden tot de geïsomeriseerde alfazuren (Engels: Isomerized Alfa Acids of IAA's) gerekend. Hoewel de reactieomstandigheden aanleiding geven tot een groot aantal oxidatieproducten, worden de isohumulonen nog steeds aangetroffen in bier.[3] Onder de omstandigheden van het brouwproces is de oplosbaarheid van de geïsomeriseerde alfazuren aanzienlijk groter dan die van humulon zelf.[4]
Biosynthese
[bewerken | brontekst bewerken]De biosynthese van humulon in Humulus lupulus begint met isovaleryl-CoA en 3 moleculen malonyl-CoA. De reactie wordt gekatalyseerd door het enzym florovalerofenonsynthetase. De reactie leidt tot het benzeendrivaat 3-methyl-1-(2,4,6-trihydroxyfenyl)butan-1-on. Uit de deoxyxyluloseroute wordt vervolgens dimethylallylpyrofosfaat gebruikt om de prenylering (het aanbrengen van de zijketens) van de aromaat tot humulon te realiseren.[5]
De beschreven reacties laten zich op onderstaande wijze in reactievergelijkingachtige regels weergeven:
- isovaleryl-CoA + 3 malonyl-CoA → 4 CoASH + 3 CO2 + 3-methyl-1-(2,4,6-trihydroxyfenyl)butan-1-on
- 3-methyl-1-(2,4,6-trihydroxyfenyl)butan-1-on + 2 DMAPP → humulon
Een belangrijk verschil tussen de twee routes is het moment waarop de hydroxylgroep op positie 3 in de cyclohexadieenring geïntroduceerd wordt.
Biologische eigenschappen
[bewerken | brontekst bewerken]In vitro blijkt humulon een breed scala aan biologische activiteit te vertonen, waaronder antibacterieel,[6][7][8][9] antioxidant,[9][10] en remming van cyclo-oxygenase-2.[11][12]
- ↑ J. de Keukeleire, G. Ooms, A. Heyerick, I Roldan-Ruiz, E. van Bockstaele, D. de Keukeleire. (2003). Formation and accumulation of alpha-acids, beta-acids, desmethylxanthohumol, and xanthohumol during flowering of hops (Humulus lupulus L.) Journal of Agricultural and Food Chemistry. 51 (15): pag.: 4436–4441 DOI:10.1021/jf034263z
- ↑ Obara et al.. (1989). A Synthetic Route to (±)-humulone Bull. Chem. Soc. Jpn.. 62 (9): pag.: 3034–3035 DOI:10.1246/bcsj.62.3034
- ↑ C.A. Blanco, A. Rojas, P.A. Caballero, F. Ronda, M. Gomez, I. Caballero. (2006). A better control of beer properties by predicting acidity of hop iso-α-acids Trends in Food Science & Technology. 17 (7): pag.: 373–377 DOI:10.1016/j.tifs.2005.11.012
- ↑ H.M. Esslinger, L. Narziss. (2003). Beer Ullmann's Encyclopedia of Industrial Chemistry pag.: 2009 – Wiley-VCH Verlag GmbH & Co. KGaA DOI:10.1002/14356007.a03_421
- ↑ M. Goese, K. Kammhuber, A. Bacher, M. H. Zenk, W. Eisenreich. (1999). Biosynthesis of bitter acids in hops. A (13)C-NMR and (2)H-NMR study on the building blocks of humulone The Federation of European Biochemical Societies Journal. 263 pag.: 447–454
- ↑ J.C. Lewis, G. Alderton, J.F. Carson, D.M. Reynolds, W.D. MacLay. (1949). Lupulon and Humulon-Antibiotic Constituents of Hops The Journal of Clinical Investigation. 28 (5): pag.: 916–919 DOI:10.1172/JCI102178
- ↑ W.F. Erdmann. (1951). Phytoncides. I. Lupulone and humulone; their antibacterial action and their use in tuberculous infections Die Pharmazie. 6 (9): pag.: 442–451
- ↑ E.R. Dumas, A.E. Michaud, C. Bergeron, J.L. Lafrance, S. Mortillo, S. Gafner. (2009). Deodorant effects of a supercritical hops extract: Antibacterial activity against Corynebacterium xerosis and Staphylococcus epidermidis and efficacy testing of a hops/zinc ricinoleate stick in humans through the sensory evaluation of axillary deodorancy Journal of cosmetic dermatology. 8 (3): pag.: 197–204 DOI:10.1111/j.1473-2165.2009.00449.x
- ↑ a b Yamaguchi, N, Satoh-Yamaguchi, K, Ono, M (2009). In vitro evaluation of antibacterial, anticollagenase, and antioxidant activities of hop components (Humulus lupulus) addressing acne vulgaris. Phytomedicine : international journal of phytotherapy and phytopharmacology 16 (4): 369–76. PMID 19201179. DOI: 10.1016/j.phymed.2008.12.021.
- ↑ M. Tagashira, M. Watanabe, N. Uemitsu. (1995). Antioxidative activity of hop bitter acids and their analogues Bioscience, Biotechnology, and Biochemistry. 59 (4): pag.: 740–742 DOI:10.1271/bbb.59.740
- ↑ K. Yamamoto, J. Wang, S. Yamamoto, H. Tobe. (2000). Suppression of cyclooxygenase-2 gene transcription by humulon of beer hop extract studied with reference to glucocorticoid FEBS Letters. 465 (2-3): pag.: 103–106 DOI:10.1016/S0014-5793(99)01727-5
- ↑ J.C. Lee, J.K. Kundu, D.M. Hwang, H.K. Na, Y.J. Surh. (2007). Humulone inhibits phorbol ester-induced COX-2 expression in mouse skin by blocking activation of NF-kappaB and AP-1: IkappaB kinase and c-Jun-N-terminal kinase as respective potential upstream targets Carcinogenesis. 28 (7): pag.: 1491–1498 DOI:10.1093/carcin/bgm054