Indium(I)bromide
| Indium(I)bromide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
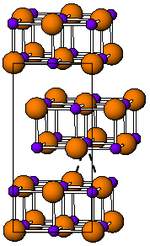
Kristalstructuur van indium(I)bromide. Bruin = broom, paars = in dium
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Indium(I)bromide | |||
| Andere namen | Indiummonobromide | |||
| Molmassa | 194,722 g/mol | |||
| SMILES | [In]Br
| |||
| CAS-nummer | 14280-53-6 | |||
| PubChem | 71317298 | |||
| Wikidata | Q4096880 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 - H318 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P260 -P303+P361+P353 -P305+P351+P338 - P301+P330+P331 - P405 - P501 | |||
| Fysische eigenschappen | ||||
| Dichtheid | 4,960 g/cm³ | |||
| Smeltpunt | 285 °C | |||
| Kookpunt | 656 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Indium(I)bromide is een chemische verbinding van indium en broom met de formule . Dit zout vormt rode kristallen die isostructureel zijn met β-TlI: een verschoven steenzout-structuur.[1]
Synthese
[bewerken | brontekst bewerken]Indium(I)bromide wordt in het algemeen uit de elementen bereid, door het verhitten in vacuüm van indium(III)bromide met metallisch indium, of door reactie van indium met kwik(II)bromide bij 350 °C.[2]
Toepassingen en reacties
[bewerken | brontekst bewerken]is gebruikt in de zwavellamp.[3] In de organische synthese bleek het de koppeling van α,α-dichloorketonen tot 1-aryl-butaan-1,4-dionen te bevorderen.[4] Met halogeenalkanen worden in een oxidatieve additie-reactie alkylindiumhalogenides gevormd[5] en met nikkelbromide-complexen worden adducten gevormd met een directe nikkel-indium-binding.[6] In waterige oplossingen is het instabiel: er wordt metallisch indium gevormd en indium(III)bromide.
Wanneer indium(I)tetrabromoindiaat(III), ([7]) wordt opgelost in water ontstaat, denkt men, als een rood, onoplosbaar neerslag dat vervolgens snel ontleedt.[8]
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Indium(I) bromide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Indium(I)-bromid op de Duitstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Met name de veiligheidsaspecten van InBr zijn hieraan ontleend.
Zie ook Indiumhalogenides
- ↑ Stephenson N.C., Mellor D.P. "The crystal structure of indium monobromide" Australian journal of scientific research A 3 (1950) 581-586
- ↑ Georg Brauer, unter Mitarbeit von Marianne Baudler u. a. (Hrsg.): Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I. Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 870.
- ↑ Engelse Wikipedia: sulfur lamp.
- ↑ C. Peppe and R. Pavão das Chagas (2004). Indium(I) Bromide-Mediated Reductive Coupling of α,α-Dichloroketones to 1-Aryl-butane-1,4-diones. Synlett (7): 1187–1190. DOI: 10.1055/s-2004-825591.
- ↑ M. J. S. Gynane, L. G. Waterworth and I. J. Worrall (1972). Oxidative addition reactions of group III metals in low oxidation states III. Reactions of indium monohalides with alkyl halides. Journal of Organometallic Chemistry 43 (2): 257–264. DOI: 10.1016/S0022-328X(00)81599-5.
- ↑ J. Weiss, T. Priermeier and R. A. Fischer (1996). Reactions of Elemental Indium and Indium(I) Bromide with Nickel-Bromine Bonds: Structure of (η5-C5H5)(Ph3P)Ni-InBr2(O=PPh3). Inorg. Chem. 35 (1): 71–75. PMID: 11666166. DOI: 10.1021/ic950614i.
- ↑ was vroeger bekend onder de naam indiumdibromide, zie indiumhalogenides
- ↑ R. Dronskowski (1994). Ambient-Temperature Formation of Crystalline Indium Monohalides from Aqueous Media. Inorg. Chem. 33 (25): 5960–5963. DOI: 10.1021/ic00103a054.




![{\displaystyle {\ce {2In\ +\ InBr3\ ->[{\ce {300\ -\ 400^{o}C}}][{\ce {Vaccuum}}]\ 3InBr}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f064010da27e8bbe89979e96819ff62521afd6eb)
![{\displaystyle {\ce {2In\ +\ HgBr2\ ->[{\ce {\ 350^{o}C\ }}]\ 2InBr\ +\ Hg}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f4f85e138028bfefbf6390b49bffd53658419048)
![{\displaystyle {\ce {In^{I}[In^{III}Br4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b74cda271a7f771a903595f2c2d7ecc62bb05b0)