Complementariteitsbepalende regio
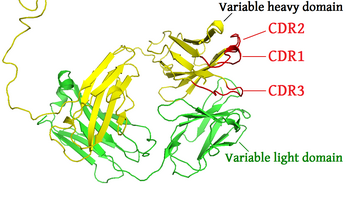
De complementariteitsbepalende regio's (CDR's) maken deel uit van de variabele ketens van immunoglobulinen (antilichamen; gemaakt door B-cellen) en T-celreceptoren (gemaakt door T-cellen). Iedere B- of T-cel maakt een eiwitmolecuul dat een specifiek antigeen kan binden. De CDR's vormen het meest variabele deel van deze antilichamen en T-celreceptoren. Ze zijn onmisbaar voor het genereren van de grote diversiteit aan antigeenbindende moleculen van lymfocyten.
Locatie en structuur[bewerken | brontekst bewerken]

De aminozuurvolgorde van het variabele domein op een antigeenreceptor bevat drie complementariteitsbepalende regio's (CDR1, CDR2 en CDR3). Deze liggen niet pal naast elkaar in het eiwit. Antigeenreceptoren bestaan gewoonlijk uit twee variabele domeinen (op twee verschillende eiwitketens; de zware en de lichte keten). Daardoor heeft elke antigeenreceptor zes CDR's die gezamenlijk in contact komen met het antigeen. Een enkelvoudig antilichaam heeft twee antigeenreceptoren, met daarop twaalf CDR's. Het pentamere IgM-molecuul heeft zestig CDR's.
De CDR's worden ook wel de hypervariabele gebieden van het immunoglobuline en de T-celreceptor genoemd, omdat ze de meeste sequentievariatie bevatten.[1] Deze variatie wordt veroorzaakt door herschikking van de betrokken genen tijdens de ontwikkeling van de lymfocyt.[2] CDR1 en CDR2 bevinden zich in het variable (V)-segment van de zware en de lichte keten. CDR3 omspant een deel van het V-segment, het volledige diversity (D)-segment – dat enkel aanwezig is op de zware keten - en het joining (J)-segment.[3] Daardoor is CDR3 het meest variabel van alle complementariteitsbepalende regio's.
Voor het analyseren en het ontwerpen van nieuwe antilichamen is de tertiaire eiwitstructuur van belang. De driedimensionale structuur van de non-H3 CDR's in antilichamen is ingedeeld en geclassificeerd door Chothia et al.[4] en recent door North et al.[5] Met homologiemodelling kan de driedimensionale structuur van een eiwit afgeleid worden uit de aminozuurvolgorde. Dit gebeurt door berekeningen aan de hand van de zogeheten H3-regels, empirische regels om CDR3-modellen te construeren.[6]
Zie ook[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|
