Conformatie
Met conformatie wordt in de organische scheikunde een welbepaalde ruimtelijke ordening aangeduid van de atomen in een organische verbinding, die zich onderscheidt van andere ordeningen die mogelijk zijn door rotaties rond enkelvoudige bindingen.
Verschillende conformaties van eenzelfde verbinding worden conformatie-isomeren of conformeren genoemd. Welke conformaties mogelijk zijn wordt bepaald door de elektrostatische interacties (afstoting, aantrekking, sterische hindering) tussen de verschillende atomen en functionele groepen in de chemische verbinding. Dit kan beïnvloed worden door externe stimuli, zoals verandering in pH en temperatuur.
Lineaire verbindingen[bewerken | brontekst bewerken]
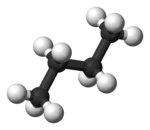
Heel wat lineaire organische moleculen komen in verschillende conformaties voor. Van ethaan komen twee belangrijke conformeren voor: een geëclipseerde en een geschrankte conformatie. Deze laatste is energetisch stabieler, omdat er geen directe alignering van bindingen voorkomt. In de geëclipseerde conformatie is dit wel het geval, hetgeen resulteert in een significant hogere energie (ongeveer 12,5 kJ/mol).
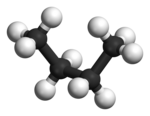
Van butaan komen diverse conformeren voor, waarvan de anti-structuur de meest stabiele is. Dit kan beredeneerd worden door de middelste binding in butaan te beschouwen en beide methylgroepen in de Newmanprojectie over die middelste binding zo ver mogelijk van elkaar te beschouwen (namelijk met een hoek van 180° ertussen). In de geëclipseerde (of syn-conformatie) bedraagt die hoek 0°, zodat dit een zeer ongunstige conformatie is. Daarnaast is ook een conformatie mogelijk waarbij de methylgroepen een hoek van 60° maken ten opzichte van elkaar: dit wordt de gauche-conformatie genoemd.
 |
 |
 |
 |
anders weergegeven |
Cyclische verbindingen[bewerken | brontekst bewerken]
In cyclische verbindingen, zoals cycloalkanen en cycloalkenen, is vanzelfsprekend de conformationele beweeglijkheid een stuk minder groot dan bij lineaire verbindingen. Zeker kleine ringen, zoals cyclopropaan en cyclobutaan, bezitten maar een beperkt aantal conformaties. Naarmate de ringgrootte toeneemt, neemt ook het aantal mogelijke conformaties toe. Sommige daarvan zijn stabieler dan andere.
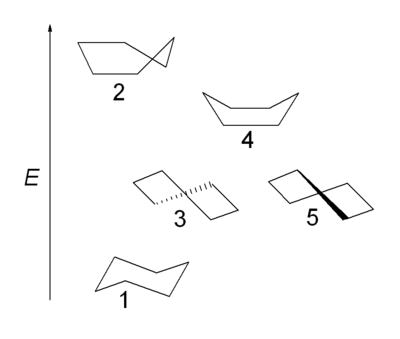
Als voorbeeld kan het zeer uitgebreid bestudeerde cyclohexaansysteem genomen worden. Cyclohexaan neemt in zijn meest stabiele vorm een zogenaamde stoelconformatie aan, waarbij telkens 6 equatoriale en 6 axiale waterstofatomen voorkomen. Naast de stoelconformatie kan cyclohexaan ook voorkomen als halve stoel (of envelop), gedraaide boot (of twist-conformatie) en als boot (ook wel zadel genoemd). Van deze vormen kan alleen de gedraaide vorm geïsoleerd worden omdat het een energieminimum vertegenwoordigt. Hoewel de bootvorm geen hoekspanning vertoont, is de energie wel hoger dan die van de stoelvorm door sterische hindering van de twee axiale waterstofatomen op de koolstofatomen 1 en 4, vaak aangeduid als de vlaggenmastinteractie. Bovendien vertonen twee van de koolstof-koolstofbindingen een zekere torsi-spanning doordat zij geëclipseerd staan. De bootvorm heeft dus een hogere energie dan de stoelvorm. In de halve stoel liggen 4 koolstofatomen in een plat vlak, waarbij twee bindingen volledig geëclipseerd staan.
Conformationele mobiliteit[bewerken | brontekst bewerken]
In tegenstelling tot stereo-isomeren of optische isomeren kunnen conformeren in elkaar overgaan zonder dat er bindingen verbroken worden; er wordt gesproken over conformationele mobiliteit of conformationele beweeglijkheid. Daarbij blijven bindingslengten en bindingshoeken behouden. Conformeren kunnen niet afzonderlijk geïsoleerd worden. Een verbinding komt gewoonlijk voor als een mengsel van conformeren die met elkaar in evenwicht zijn, waarbij de meest stabiele conformatie, die met de laagste energie-inhoud, domineert. Bij cyclohexaan is dat de stoelconformatie.
Invloed van conformaties op de enzymatische activiteit[bewerken | brontekst bewerken]
De conformatie van een molecule heeft een invloed op de fysische eigenschappen van de stof en de mogelijke chemische reacties. Dit is bijvoorbeeld het geval bij enzymen: deze zijn enkel actief als katalysator van een reactie in welbepaalde conformaties. Als de conformatie licht wijzigt door bijvoorbeeld een pH- of temperatuursverandering, kan het enzym zijn katalytische werking verliezen. Dit fenomeen wordt denaturatie genoemd.
In de farmaceutische industrie wordt ook een belangrijk deel van de ontwikkeling van nieuwe biologisch actieve moleculen gespendeerd aan onderzoek naar de meest stabiele conformatie. Die bepaalt namelijk of de interacties met het doelwit in het lichaam (zoals een eiwit, het DNA of een celmembraan) optimaal zijn of niet. Desgevallend kan de moleculaire structuur van de onderzochte verbinding worden aangepast, zodat een betere conformatie wordt bekomen. Een voorbeeld hiervan is de ontwikkeling van de oripavines uit morfine, waarbij een extra ring is aangebracht om de conformationele mobiliteit aan banden te leggen en op die manier een betere activiteit te induceren. Er wordt daarbij gesproken over structurele rigidificatie.
