G-proteïne

G-proteïne[1] (guanine nucleotide bindende eiwitten) of G-eiwit is een familie proteïnes betrokken bij de signaaloverdracht buiten de cel die veranderingen binnen de cel veroorzaakt. G-eiwitten zijn betrokken bij de signaaloverdracht van veel hormonen, neurotransmitters en andere signaalmoleculen.
Het G-proteïne bestaat uit twee delen, namelijk een α- en βγ-deel. Wanneer het G-proteïne inactief is bindt het α-deel met GDP. Het βγ-deel zit dan aan het α-deel vast. Als het G-proteïne actief is, is het gebonden met GTP en het α- en βγ-deel zijn van elkaar gesplitst. Het α-deel en/of βγ-deel kunnen dan reageren met een effector. Het G-proteïne werkt samen met de G-proteïnegekoppelde receptor (GPCR). Voorbeelden zijn onder meer adenylylcyclasen, G-proteïne-gekoppelde receptorkinasen (GRK's) en fosfolipasen. Er bestaan verschillende isoforms van de individuele subeenheden. Tot op heden zijn er 21 verschillende αG-eiwitsubeenheden, 5 β-subeenheden en 12 γ-subeenheden bekend.
G-proteïnegekoppelde receptoren zijn membraanreceptoren die zich in het celmembraan bevinden, en signalen kunnen ontvangen van de buitenkant van het membraan, en een respons geven aan de binnenkant van het membraan. De receptor aan de binnenkant van het membraan activeert een G-proteïne, die vervolgens een cascade van andere reacties in gang zet en zo een verandering elders in de cel bewerkstelligt.
De G-proteïnes reguleren metabolische enzymen, ionkanalen, transporteiwitten en veel andere kritische processen in de cel.
De familie werd voor het eerst ontdekt door Alfred Gilman en Martin Rodbell, die de stimulatie van cellen door adrenaline onderzochten. Ze ontdekten dat wanneer adrenaline aan een receptor bindt, de receptor niet direct invloed uitoefent op de enzymen, maar dat een G-proteïne wordt gestimuleerd, dat weer een enzym beïnvloedt. Een voorbeeld hiervan is adenylylcyclase, wat de second messenger cyclisch AMP produceert. Voor deze ontdekking wonnen ze in 1994 de Nobelprijs voor de Fysiologie of Geneeskunde.
G-proteïne maakt onderdeel uit van de grotere groep enzymen GTPase.
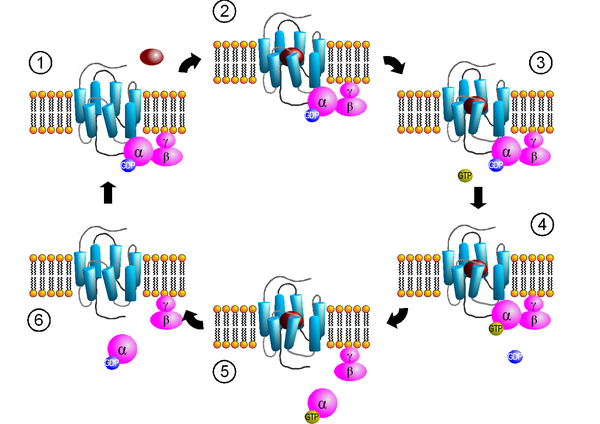
(1) Binding van het G-Proteïne; (2) Ligandbinding; (3) Activering van de receptor; (4) Activering van het G-Proteïne; (5) Dissociatie van het G-Proteïne en signaaltransductie; (6) Inactivering van het G-Proteïne. GTP=Guanosinetrifosfaat, GDP=Guanosinedifosfaat

Onderfamilies
[bewerken | brontekst bewerken]- Gs-eiwitten: cAMP-afhankelijke reacties
- Gi-eiwitten: remmende G-eiwitten
- Gq-eiwitten: Fosfolipase-C-gekoppelde G-eiwitten
Kleine G-eiwitten (monomeer)
[bewerken | brontekst bewerken]Kleine G-eiwitten (kleine GTP-asen) zijn monomere GTP-bindende eiwitten met een molecuulmassa van 20 tot 40 kDa. Momenteel zijn er meer dan 100 verschillende kleine G-eiwitten bekend, die op basis van fylogenetische overeenkomsten en verschillen in 5 families zijn verdeeld: Ras ((HRas, KRas en NRas), Rho, Rab, Sar1/Arf en Ran. Ze zijn betrokken bij de regulatie van talrijke celfuncties in de celcyclus, zoals de regulatie van genexpressie (Ras en Rho), de regulatie van het cytoskelet (Rho), de regulatie van blaasjestransport (Rab en Sar1/Arf) en de regulatie van transport tussen het cytoplasma en de celkern (Ran). De kleine G-eiwitten gaan over van een inactieve, GDP-gebonden vorm in het cytosol naar een actieve, GTP-gebonden vorm op het celmembraan. Ze worden geremd door 14-3-3-eiwitten.[2]
- ↑ Everdingen, J.J.E. van, Eerenbeemt, A.M.M. van den (2012). Pinkhof Geneeskundig woordenboek (12de druk). Houten: Bohn Stafleu Van Loghum.
- ↑ Philippe Riou, Svend Kjaer u. a.: 14-3-3 Proteins Interact with a Hybrid Prenyl-Phosphorylation Motif to Inhibit G Proteins. In: Cell. 153, 2013, S. 640–653, doi:10.1016/j.cell.2013.03.044.
