Waterstofhypochloriet
| Waterstofhypochloriet | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
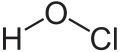
| ||||
Structuurformule van waterstofhypochloriet
| ||||
| Algemeen | ||||
| Molecuulformule | HClO | |||
| IUPAC-naam | waterstofhypochloriet | |||
| Andere namen | hypochloorzuur, chloor(I)zuur | |||
| Molmassa | 52,46034 g/mol | |||
| SMILES | OCl
| |||
| InChI | 1/ClHO/c1-2/h2H
| |||
| CAS-nummer | 7790-92-3 | |||
| EG-nummer | 232-232-5 | |||
| PubChem | 24341 | |||
| Wikidata | Q407318 | |||
| Goed oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKa = 7,49[1] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Waterstofhypochloriet, hypochloorzuur of onderchlorigzuur is een zwak en instabiel anorganisch zuur met als brutoformule HClO. Het komt als zodanig enkel voor in een waterige oplossing. Waterstofhypochloriet behoort tot de groep der halogeenzuurstofzuren.
Synthese
[bewerken | brontekst bewerken]Een oplossing van waterstofhypochloriet kan bereid worden door dichloormonoxide op te lossen in water:[2]
Het ontstaat tevens bij het oplossen van chloorgas in water, waarbij ook waterstofchloride gevormd wordt:[3]
Beide reacties zijn evenwichtsreacties. Het is daardoor onmogelijk om het watervrije zuur te bereiden.
Eigenschappen en reacties
[bewerken | brontekst bewerken]In water reageert waterstofhypochloriet als een (zeer) zwak zuur (met een pKa van ongeveer 7,5 is het zo'n 1000 keer minder zuur dan azijnzuur) en een sterke oxidator. Het zuur is zelfs in waterige oplossing niet stabiel: er treedt langzame ontleding op waarbij dichloor, dizuurstof en waterstofperchloraat ontstaan.[1] De kleur van de oplossing is groengeel, afkomstig van het chloorgas dat wordt gevormd. De zouten van waterstofhypochloriet zijn stabieler en worden gebruikt als bleekmiddelen en oxidatoren. Voorbeelden hiervan zijn natriumhypochloriet en calciumhypochloriet.
Het toevoegen van een zoutzuur aan een oplossing van waterstofhypochloriet leidt tot vorming van chloorgas:
Deze reactie treedt ook op bij oplossingen van zouten van het zuur, zoals met natriumhypochloriet:
Het is bekend dat waterstofhypochloriet met een groot aantal biologische moleculen reageert, waaronder het DNA, RNA,[4] vetzuren, cholesterol[5] en proteïnen.[6]
Toepassingen
[bewerken | brontekst bewerken]Waterstofhypochloriet wordt in de organische synthese gebruikt bij de omzetting van alkenen naar chloorhydrines.[7] Zo wordt 2-chloorethanol gesynthetiseerd uit etheen:
Verder wordt het ingezet als bleekmiddel en oxidator. In die hoedanigheid treedt het op als desinfecterend middel, onder andere in zwembaden.
Zie ook
[bewerken | brontekst bewerken]Externe links
[bewerken | brontekst bewerken]- (en) MSDS van waterstofhypochloriet
- (en) Gegevens van waterstofhypochloriet in de GESTIS-stoffendatabank van het IFA
- ↑ a b Merck 13,4891
- ↑ (en) G. Brauer (1963) - Handbook of Preparative Inorganic Chemistry, 2nd ed., Academic Press, pp. 308-309
- ↑ G.M. Fair, J. Corris, S.L. Chang, I. Weil & R.P. Burden (1948) - The behavior of chlorine as a water disinfectant, J. Am. Water Works Assoc., 40, pp. 1051-1061
- ↑ (en) W.H. Dennis Jr., V.P. Olivieri & C.W. Krusé (1979) - The reaction of nucleotides with aqueous hypochlorous acid, Water Res., 13 (4), pp. 357-362
- ↑ (en) A.C. Carr, J.J. Van Den Berg, C.C. Winterbourn (1996) - Chlorination of cholesterol in cell membranes by hypochlorous acid, Archives of biochemistry and biophysics, 332 (1), pp. 63-69
- ↑ (en) W.C. Barrette Jr., D.M. Hannum, W.D. Wheeler & J.K. Hurst (1989) - General mechanism for the bacterial toxicity of hypochlorous acid: abolition of ATP production, Biochemistry, 28 (23), pp. 9172-9178
- ↑ (en) P.C. Unangst (2004) - Hypochlorous Acid, Encyclopedia of Reagents for Organic Synthesis (uitgever: L. Paquette), J. Wiley & Sons, New York





