Arbeid (thermodynamica)
Het begrip arbeid (of werk) heeft in de thermodynamica een aanzienlijke ontwikkeling ondergaan. Arbeid is, zoals warmte, een methode van energieoverdracht en is een maat voor het werk dat gedaan wordt, of de inspanning die door een krachtbron geleverd wordt bij verplaatsing van een volumemassa.
Definitie[bewerken | brontekst bewerken]
De definitie van arbeid is het scalair product van een kracht en een weglengte , waarover de kracht wordt uitgeoefend.
met:
- de arbeid die het systeem levert aan zijn omgeving [J]
- de kracht die de omgeving uitoefent op het systeem [N]
- de afstand van de verplaatsing van het systeem ten gevolge van de kracht [m]
Voorbeeld[bewerken | brontekst bewerken]
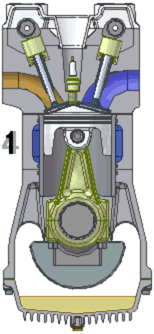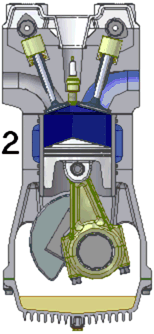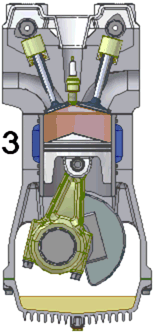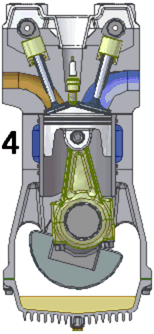
Een praktijkvoorbeeld is de arbeid die een gas onder druk uitoefent op een zuiger, zoals in een verbrandingsmotor. De verbrandingsgassen bevinden zich onder hoge druk in een gesloten volume en oefenen een kracht uit op een beweegbare zuiger. Deze kracht van het gas op de zuiger is gelijk aan het product van de druk en het zuigeroppervlak . De zuiger beweegt zich over een afstand . Het volume van het gas neemt toe met een volume . Het gas oefent hierdoor een volumearbeid uit op de zuiger:
met
- de arbeid die het systeem levert aan zijn omgeving [J]
- de kracht die de omgeving uitoefent op het systeem [N]
- de afstand van de verplaatsing van het systeem ten gevolge van de kracht [m]
- de druk van het gas in het gesloten volume [Pa]
- het zuigeroppervlak [m²]
- de volumeverandering van het gas [m³]
Eerste hoofdwet van de thermodynamica[bewerken | brontekst bewerken]
Macroscopisch controlevolume[bewerken | brontekst bewerken]
Een van de eerste realisaties in de ontwikkeling van de thermodynamica was dat warmte en arbeid beide vormen van energieoverdracht zijn en dat energie binnen een controlevolume of een gesloten systeem volgens de eerste wet van de thermodynamica een behouden grootheid is:
met
- de inwendige energie van het systeem[J]
- de warmte die het systeem ontvangt van zijn omgeving [J]
- de arbeid die het systeem levert aan zijn omgeving [J]
De warmte is hierbij positief indien het systeem warmte van zijn omgeving ontvangt. Hierdoor neemt namelijk de inwendige energie van het systeem toe, aangezien het systeem energie in de vorm van warmte ontvangt. De arbeid is positief indien het systeem arbeid levert aan zijn omgeving. Hierdoor neemt namelijk de inwendige energie van het systeem af, aangezien het systeem deze energie afstaat aan zijn omgeving in de vorm van arbeid.
Infinitesimaal controlevolume[bewerken | brontekst bewerken]
Een infinitesimaal controlevolume is een zeer klein volume. Gebruikmakend van de begrippen volumearbeid (), entropie () en absolute temperatuur () kan een verandering van de energie in dit zeer kleine controlevolume geschreven worden als:
waarin een differentiaal betekent.
Later ging men beseffen dat er vele andere vormen van energieoverdracht bestaan, zoals chemische energie, elektrische energie, magnetische energie, kinetische energie, elastische energie, oppervlakte-energie enz. Deze vormen van energie zijn allemaal vormen van 'arbeid'. De bovenstaande formule kan uitgebreid worden met extra termen om deze andere vormen van arbeid in te sluiten in het thermodynamisch formulisme:
Voor elektrische energie bijvoorbeeld is de elektrische lading en de elektrische spanning.
Voor een overgang van warmte naar een vorm van arbeid gelden de beperkingen van de Tweede Hoofdwet, waardoor altijd maar een deel van de warmte in arbeid wordt omgezet en de rest als afvalwarmte afgevoerd moet worden door een vorm van koeling. Voor een overgang van de ene vorm van arbeid in de andere gelden die beperkingen niet. Het is thermodynamisch gesproken in principe mogelijk om dat met 100% rendement te doen, hoewel er in de praktijk meestal wel wat verliezen (naar warmte) plaatsvinden. Dit is meteen de reden waarom deze verdere energietermen allemaal als 'arbeid' gerekend worden.





















