Arseen(III)fluoride
| Arseen(III)fluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Formule van
| ||||
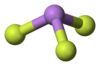
| ||||
Model van
| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Arseen(III)fluoride | |||
| Andere namen | Arseentrifluoride, trifluorarsaan, TL-156 | |||
| Molmassa | 131,9168 g/mol | |||
| SMILES | F[As](F)F
| |||
| InChI | 1/AsF3/c2-1(3)4
| |||
| CAS-nummer | 7784-35-2 | |||
| PubChem | 24571 | |||
| Wikidata | Q425213 | |||
| Beschrijving | Kleurloze olieachtige vloeistof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H301 - H311 - H331 | |||
| P-zinnen | P261 - P264 - P270 - P271 - P280 - P301+P310 - P302+P352 - P304+P340 - P311 - P312 - P321 - P322 - P330 - P361 - P363 - P403+P233 - P405 - P501 | |||
| EG-Index-nummer | 232-060-0 | |||
| VN-nummer | R4I21S44T9 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | Vloeistof | |||
| Kleur | KLeurloos | |||
| Dichtheid | (0 °C)[1] 2,666 g/cm³ | |||
| Smeltpunt | -8,5 °C | |||
| Kookpunt | 60,4 °C | |||
| Oplosbaarheid in water | Ontleed | |||
| Goed oplosbaar in | Ethanol, Ether, Benzeen, Ammonia | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
-821,3 kJ/mol | |||
| Nutritionele eigenschappen | ||||
| Type additief | eeft | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Arseen(III)fluoride is een chemische verbinding van arseen en fluor met de formule . Het is een heldere, kleurloze vloeistof die makkelijk met water(damp) reageert.[2]
Synthese en eigenschappen[bewerken | brontekst bewerken]
kan verkregen worden uit de reactie van waterstoffluoride met arseen(III)oxide:[2]
Zowel als vaste stof en in de gasfase heeft het molecuul de structuur van een driezijdige piramide.[2] In de gasfase is de bindingslengte tussen arseen en fluor 170,6 pm, de F-As-F bindingshoek is 96,2°.[3]
Arseen(III)fluoride wordt als fluoriderend reagens toegepast om niet-metaalchlorides om te zetten in de overeenkomstige fluorides. Voor dit doel is het echter minder reactief dan het verwante antimoon(III)fluoride .[2]
Zouten met als anion zijn bekend met en als voorbeelden.[4] In het kaliumzout , gesynthetiseerd uit en bevat het ion én het neutrale molecuul , waarbij er ook een aantoonbare interactie is tussen neutraal molecuul en anion.[5]
Arseen(III)fluoride reageert met antimoon(V)fluoride. Het product kan zowel beschreven worden als de ionogene stof of als een neutraal adduct . De kristalstructuur vertoont aspecten van beide beschrijvingen, met de conclusie dat de waarheid, letterlijk, in het midden ligt.[6]
Bronnen, noten en/of referenties
|






![{\displaystyle {\ce {Cs[AsF4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0a49e25dc16dd56c9324aaaa06f6df53d99253e6)
![{\displaystyle {\ce {[(CH3)4N]^{+}[AsF4]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e5cb41d81b2a64a196008a9e8bcf71d01a0de53)


![{\displaystyle {\ce {[AsF2]^{+}[SbF6]^{-}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d08dd0f228a66e0f42e2da180eef974c1d455b70)
