Natriumacetaat
| Natriumacetaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
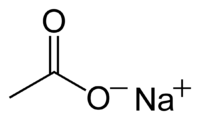
| ||||
Structuurformule van watervrij natriumacetaat
| ||||

| ||||
Natriumacetaatkristal
| ||||
| Algemeen | ||||
| Molecuulformule | CH3COONa | |||
| IUPAC-naam | natriumethanoaat | |||
| Andere namen | natrium aceticum, sodii acetas | |||
| Molmassa | 82,03379 g/mol | |||
| SMILES | CC(=O)[O-].[Na+]
| |||
| InChI | 1/C2H4O2.Na/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1/fC2H3O2.Na/q-1;m
| |||
| CAS-nummer | 127-09-3 | |||
| EG-nummer | 204-823-8 | |||
| PubChem | 517045 | |||
| Wikidata | Q339940 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Hygroscopisch? | ja | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,42-1,52[1] g/cm³ | |||
| Smeltpunt | (ontleedt) 324[1] °C | |||
| Vlampunt | > 250[1] °C | |||
| Zelfontbrandings- temperatuur | 607[1] °C | |||
| Oplosbaarheid in water | 365[1] g/L | |||
| Goed oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | monoklien | |||
| Nutritionele eigenschappen | ||||
| ADI | 15 mg/kg lichaamsgewicht | |||
| Type additief | conserveermiddel, buffer | |||
| E-nummer | E262 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Natriumacetaat (systematische naam: natriumethanoaat), is het natriumzout van azijnzuur (ethaanzuur). De zuivere stof komt voor als kleurloze tot witte kristallen, die zeer goed oplosbaar zijn in water. Het is een relatief goedkope grondstof die op grote schaal industrieel wordt toegepast. Natriumacetaat komt ook voor als een trihydraat.
Synthese
Natriumacetaat kan eenvoudigweg bereid worden door middel van een zuur-basereactie van azijnzuur met een basisch natriumzout zoals natriumcarbonaat of natriumhydroxide:
De oplossing kan ingedampt worden om de gehydrateerde kristallen te verkrijgen.
Toepassingen
Natriumacetaat wordt gebruikt in de textielindustrie om afvalstromen van zwavelzuur te neutraliseren, en als fotoresist in anilinekleurstoffen. Het wordt ook gebruikt om het vulkaniseren van chloropreen af te remmen in de productie van synthetisch rubber.
Natriumacetaat is de stof die bepaalde chips hun zoute smaak geeft. Het kan ook aan voedsel toegevoegd worden als conserveermiddel; het wordt dan meestal geschreven als natriumdiacetaat of als E-nummer (E262).
Als geconjugeerde base van een zwak zuur kan een oplossing van natriumacetaat en azijnzuur als buffer dienen om een relatief constante pH te behouden. Dit is vooral nuttig in biochemische toepassingen waar reacties pH-afhankelijk zijn.
Natriumacetaat is bij het grote publiek waarschijnlijk het bekendst als natriumacetaat-verwarmertje en wordt ook gebruikt als heet ijs. Wanneer natriumacetaattrihydraat-kristallen (smeltpunt 58°C) verhit worden tot ongeveer 100°C smelten ze. Wanneer dit afkoelt ontstaat een oververzadigde oplossing van natriumacetaat in water. Deze oplossing kan superkoelen naar kamertemperatuur, ver onder het smeltpunt, zonder kristallen te vormen. Door een metalen schijfje te knikken in de oplossing ontstaat een nucleatiecentrum waardoor de oplossing uitkristalliseert. Dit proces is exotherm, waardoor warmte vrijkomt.[2][3][4]
Externe links
- ↑ a b c d e (en) Gegevens van natriumacetaat in de GESTIS-stoffendatabank van het IFA (geraadpleegd op 30 november 2008)
- ↑ Crystallization of Supersaturated Sodium Acetate. Journal of Chemical Education.
- ↑ "Fake" latent heat and supersaturation
- ↑ How do sodium acetate heat pads work?. HowStuffWorks. Geraadpleegd op 14 november 2007.


