Organoseleenchemie
In de organoseleenchemie worden verbindingen bestudeerd waarin een directe binding optreedt tussen koolstof en seleen. Zowel de eigenschappen van de verbindingen als in synthese en reacties worden bestudeerd. Seleen wordt tot de niet-metalen gerekend, en als zodanig is de organoseleenchemie geen onderdeel van de organometaalchemie.[1] Seleen hoort tot de zuurstofgroep in het periodiek systeem en overeenkomsten tussen de chemie van seleen enerzijds en de bekendere leden van deze groep, zuurstof en zwavel anderzijds, zijn te verwachten.
De eerste organoseleenverbinding, di-ethylselenide, is in 1836 beschreven door L.C.J. Pogg[2]
Eigenschappen van de koolstof - elementbinding in de zuurstofgroep[bewerken | brontekst bewerken]
Van seleen zijn de oxidatietoestanden -2, +2, +4, +6 bekend. In de organoseleenchemie speelt vooral Se(II) een belangrijke rol. Gaande door de zuurstofgroep wordt de bindingssterkte tussen koolstof en de elementen geleidelijk zwakker en de bindingslengte groter:
| Element | Bindingsenergie (kJ/mol) |
Bindingslengte (pm) |
pKz voor XH2 | pKz voor (C6H5)XH |
|---|---|---|---|---|
| O | 141 | 16 | 9.89[3] | |
| S | 272 | 181 | 7 | 6.5 |
| Se | 234 | 198 | 3.8 | 5.9 |
Seleenverbindingen vormen betere nucleofielen dan de overeenkomstige zwavelverbindingen, en de hydriden zijn zuurder, zoals uit de tabel blijkt. In tegenstelling tot de sulfoxiden zijn de seleenoxides niet stabiel als ze over een β-proton beschikken; deze eigenschap wordt in een groot aantal syntheses uitgebuit, met name in de seleenoxide-oxidaties en -eliminaties. Organoseleenverbindingen komen in zeer kleine hoeveelheden in het milieu voor (water, aarde, sediment).[4]
Verschillende typen organoseleenverbindingen[bewerken | brontekst bewerken]
Selenolen[bewerken | brontekst bewerken]
Selenolen (RSeH) zijn de seleenanaloga van de alkanolen en de thiolen. De verbindingen zijn tamelijk instabiel en hebben over het algemeen een onprettige geur. Benzeenselenol (ook wel fenylselenol, selenafenol, PhSeH of ΦSeH) is zuurder (pKz 5.9) dan thiofenol of fenol (zie tabel) en oxideert ook makkelijker tot het diselenide dan benzeenthiol. Selenafenol wordt gesynthetiseerd via de reductie van difenyldiselenide.[5]
Diseleniden[bewerken | brontekst bewerken]
Diseleniden (R-Se-Se-R) zijn de seleen-analoga van de peroxiden en de disulfiden. Deze stoffen worden veel toegepast als stabiele uitgangsstof voor de meer reactieve organoseleenverbindingen als de selenolen en de selenenylhalogeniden. In de organische chemie wordt difenyldiselenide veel toegepast. Deze verbinding wordt zelf via PhSeMgBr uit fenylmagnesiumbromide en seleen bereid.[6]
Selenylhalogeniden[bewerken | brontekst bewerken]
Selenenylhalogeniden (R-Se-Cl, R-Se-Br) ontstaan bij het halogeneren van de diseleniden. Zo ontstaat fenylselenylbromide (PhSeBr) uit broom en difenyldiselenide. Deze verbindingen vormen een bron van "PhSe+".
Seleniden[bewerken | brontekst bewerken]
Seleniden (R-Se-R), ook bekend als selenoethers, vormen de seleen-equivalenten van de ethers en de thio-ethers. Dit is de grootste groep organoseleenverbindingen. Symmetrische seleniden worden meestal gesynthetiseerd via alkylering van alkaliseleniden als natriumselenide. De niet symatrische seleniden ontstaan via alkyleren van selenoaten.
De seleniden reageren vooral als nucleofiel, onder anderen met alkylhalydes (R"-X), waarbij selenoniumzouten RR'R"Se+X− ontstaan. Met zachte heteroatomen reageert divalent seleen onder vorming van hypervalente seleenclusters.[7] In sommige gevallen, met organolithiumreagentia treden de seleniden op als elektrofiel, waarbij aat complexen ontstaan: R'RRSe−Li+.
Selenoxiden[bewerken | brontekst bewerken]
Selenoxiden (R-Se(O)-R) zijn de seleen-analoga van de sulfoxiden. Ze zijn makkelijk te oxideren tot de selenonen, de seleenvariant van de sulfonen.
Perseleenzuren[bewerken | brontekst bewerken]
Perseleenzuren (RSe(O)OOH) worden toegepast als katalysator in epoxidatie en in de Baeyer–Villiger oxidatie.
Selenuraan[bewerken | brontekst bewerken]
Selenuranen zijn hypervalente organoseleenverbindingen, die formeel beschouwd kunnen worden als derivaten van SeCl4. Gedacht moet worden aan verbindingen van het type ArSeCl3.[8] De chloriden worden gesynthetiseerd uit selenenylchloride met chloor.
Seleniraan[bewerken | brontekst bewerken]
De epoxiden en episulfiden hebben in de seleniranen hun analoga. De verbindingen bezitten een driering, met seleen als een van de ringatomen (de stamverbinding is: C2H4Se). In tegenstelling tot de thiiranen zijn de seleniranen kinetisch instabiel: het seleenatoom wordt onder vorming van een alkeen zonder oxidatie spontaan afgestaan. Deze eigenschap is in de synthetisch organische chemie toegepast.[9]
Selon[bewerken | brontekst bewerken]
De selonen (R2C=Se, soms, foutief, als selenonen benoemd) zijn als verbinding vergelijkbaar met ketonen. Het is een zeer zeldzame groep verbindingen, gezien hun neiging tot oligomerisatie.[10]. Diselenobenzoquinon is stabiel als metaalcomplex.[11]
Organoseleenverbindingen in de natuur[bewerken | brontekst bewerken]
Hoewel in kleine hoeveelheden, is seleen een biologisch noodzakelijk element. Selenocysteïne is een selenol-bevattend aminozuur dat op een speciale manier in DNA gecodeerd wordt. Selenomethionine komt ook als natuurlijk aminozuur voor, maar deze selenidefunctie wordt als post-transcriptie modificatie gerealiseerd. In Glutathionoxidase vormt een diselenide een essentieel onderdeel van het reactieve centrum.
Organoseleenverbindingen in de organische synthese[bewerken | brontekst bewerken]
Organoseleenverbindingen vormen een gespecialiseerde, maar zeer bruikbare, groep reagentia in het arsenaal van de synthetisch organisch chemicus. In de synthese van farmaceutische producten is de toepasbaarheid echter, vanwege wet- en regelgeving beperkt. De bruikbaarheid van de verbindingen wordt vooral bepaald door twee belangrijke factoren:
- de geringe bindingssterkte van de koolstof - seleenbinding
- het gemak waarmee seleen(II)verbindingen geoxideerd kunnen worden.
Vinylische seleniden[bewerken | brontekst bewerken]
Vinylische seleniden zijn organoseleenverbindingen waarbij seleen als substituent aan een dubbele binding optreedt. Deze groep stoffen speelt een rol in de stereoselectieve organische synthese van gefunctionaliseerde alkenen. [12] Hoewel er verschillende syntheseroutes naar deze reagentia beschreven zijn verloopt de voornaamste route via alkynen, zowel eindstandig als dubbelgesubstitueerd. De reactie kan zowel een nucleofiele als een elektrofiele additie van een organoseleenverbindingen aan het alkyn betreffen. [13] Zo leidt de nucleofiele additie van selenofenol aan alkynen voornamelijk tot de Z-vinylseleniden na een lange reactietijd bij kamertemperatuur. Bij hogere temperatuur is de reactie, uiteraard, sneller maar er ontstaat een mengsel van Z- en E-vinylseleniden in een vrijwel 1:1 verhouding. [14]
Onder invloed van palladium als katalysator worden de Markownikovproducten in goede opbrengsten gevormd. Bij een (eindstandig) 1-alkyn koppelt de seleengroep dan aan het koolstofatoom op de 2-positie.
Aan de beschreven syntheseroutes kleven wel nadelen: er wordt gebruikgemaakt van diorganodiseleniden of selenofenol als uitgangsmateriaal. De synthese van deze reagentia is niet eenvoudig, ze zijn vluchtig en hebben doorgaans een onplezierige geur.
Seleenoxide oxidaties[bewerken | brontekst bewerken]
In een allylische oxidatie wordt een CH2-groep direct naast een dubbele binding geoxideerd tot een allylisch alkanol of een keton. Door de aanwezigheid van de dubbele binding is deze omzetting niet via de standaard reagentia toegankelijk, de dubbele binding wordt vaak eerder geoxideerd dan de plaats ernaast. Seleendioxide is een voorbeeld van een groep oxidatoren waarmee deze omzetting wel te realiseren is. De oxidatie van cycloheptatrieen (tot tropon),[15] β-Pineen,[16] en cyclohexanon tot 1,2-cyclohexaandion[17] zijn voorbeelden van deze reactie.

In het reactiemechanisme van deze reacties spelen radicalen vaak een rol, al zijn ook gevallen beschreven van pericyclische geconcerteerde reacties in de seleenoxide-oxidatie. De eerste stap is een een-reactie, waarin een allylisch proton wordt overgedragen aan de seleenoxidegroep, de tweede stap bestaat uit een [2,3] sigmatrope reactie.
De oxidatie met seleenhoudende verbindingen wordt vaak uitgevoerd met een katalytische hoeveelheid seleen en een oxidator zoals waterstofperoxide. Selenigzuur (H2SeO3) en pyridiniumchlorochromaat worden ook als zodanig toegepast.
De reactie kan uitgebreid worden tot ketonen die over β-methyleengroepen beschikken. Deze reactie is bekend onder de naam: Riley oxidatie.[18]
Eliminaties met Seleenoxide[bewerken | brontekst bewerken]
In aanwezigheid van een β-proton zal een selenide na de oxidatie een eliminatiereactie ondergaan waarbij een alkeen en een selenol ontstaan. Tijdens de eliminatie zijn de vijf deelnemende atomen een coplanair, de reactie is een syn eliminatie. Oxidatoren die voor dit doel gebruikt worden zijn waterstofperoxide, ozon of MCPBA. De reactie wordt vooral toegepast op ketonen met een enon als synthetische doelverbinding. Een voorbeeld is de eliminatie van acetylcyclohexanon met benzeenselenylchloride en natriumhydride[19]
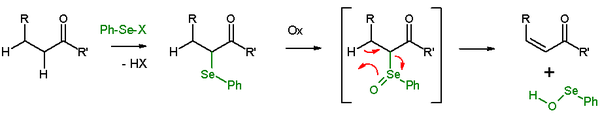
De Grieco-eliminatie is een vergelijkbare reactie waarbij o-nitrofenylselenocyanaat en tributylfosfine toegepast worden om de elementen van H2O uit een verbinding te elimineren.
[bewerken | brontekst bewerken]
Navigatie Koolstof-elementbinding
- ↑ Zie:
- A. Krief, L. Hevesi. (1988). Organoselenium Chemistry I. Functional Group Transformations. – Springer (Berlijn) ISBN 3540186298
- . (1986). Ed.: S. Patai, Z. Rappoport The Chemistry of Organic Selenium and Tellurium Compounds Vol 1. – John. Wiley and Sons (Chichester) ISBN 0-471-90425-2
- C. Paulmier. (1986). Ed.: J.E. Baldwin Selenium Reagents and Intermediates in Organic Synthesis. – Pergamon Books Ltd. (New York) ISBN 0-08-032484-3
- Diana M. Freudendahl, Stefano Santoro, Sohail A. Shahzad, Claudio Santi, Thomas Wirth. (2009). Green Chemistry with Selenium Reagents: Development of Efficient Catalytic Reactions Angewandte Chemie International Edition. 48 8409 DOI:10.1002/anie.200903893
- ↑ L.C.J. Pogg. (1836). Ann.. 37 552
- ↑ Nivon-commissie. (1986). BINAS. – Wolters - Noordhof (Groningen) ISBN 90-01-89351-1
- ↑ D. Wallschläger, F. Feldmann. (2010). Formation, Occurrence, Significance, and Analysis of Organoselenium and Organotellurium Compounds in the Environment Metal Ions in Life Sciences (volume 7), Organometallics in Environment and Toxicology. 319–364 – RSC Publishing ISBN 978-1-84755-177-1
- ↑ Zie:
- ↑ Zie:
- ↑ Anna J. Mukherjee, Sanjio S. Zade, Harkesh B. Singh and Raghavan B. Sunoj. (2010). Organoselenium Chemistry: Role of Intramolecular Interactions Chem. Rev.. DOI:10.1021/cr900352j
- ↑ Kin-ya Akiba. (1999). Chemistry of hypervalent compounds. – ISBN 978-0-471-24019-8
- ↑ Jacek M?ochowski, Krystian Kloc, Rafa? Lisiak, Piotr Potaczek, and Halina Wójtowicz. (2006). Developments in the chemistry of selenaheterocyclic compounds of practical importance in synthesis and medicinal biology Arkivoc.
- ↑ . DOI:10.1021/ar980073b
- ↑ H. Amouri, J. Moussa, A.K. Renfrew, P.J. Dyson, M.N. Rager, L.-M. Chamoreau. (2010). Discovery, Structure, and Anticancer Activity of an Iridium Complex of Diselenobenzoquinone Angewandte Chemie International Edition. 49 7530–7533 DOI:10.1002/anie.201002532
- ↑ João Valdir Comasseto, Lo Wai Ling, Nicola Petragnani, Helio Alexandre Stefani. (1997). Vinylic Selenides and Tellurides - Preparation, Reactivity and Synthetic Applications Synthesis. 1997 373 DOI:10.1055/s-1997-1210
- ↑ Zie:
- J. Comasseto. (1983). Vinylic selenides Journal of Organometallic Chemistry. 253 131 DOI:10.1016/0022-328X(83)80118-1
- Gilson Zeni, Marcelo P. Stracke, Cristina W. Nogueira, Antonio L. Braga, Paulo H. Menezes, Helio A. Stefani. (2004). Hydroselenation of Alkynes by Lithium Butylselenolate: an Approach in the Synthesis of Vinylic Selenides Organic Letters. 6 1135 DOI:10.1021/ol0498904
- M. Dabdoub. (2001). Synthesis of (Z)-1-phenylseleno-1,4-diorganyl-1-buten-3-ynes: hydroselenation of symmetrical and unsymmetrical 1,4-diorganyl-1,3-butadiynes Tetrahedron. 57 4271 DOI:10.1016/S0040-4020(01)00337-4
- O. Doregobarros, E. Lang, C. Deoliveira, C. Peppe, G. Zeni. (2002). Indium(I) iodide-mediated chemio-, regio-, and stereoselective hydroselenation of 2-alkyn-1-ol derivatives Tetrahedron Letters. 43 7921 DOI:10.1016/S0040-4039(02)01904-4
- ↑ J. Comasseto. (1981). Stereoselective synthesis of vinylic selenides Journal of Organometallic Chemistry. 216 287 DOI:10.1016/S0022-328X(00)85812-X
- ↑ Zie:
- ↑ Zie:
- ↑ Zie:
- ↑ Harry Lister Riley, John Frederick Morley, Norman Alfred Child Friend. (1932). 255. Selenium dioxide, a new oxidising agent. Part I. Its reaction with aldehydes and ketones Journal of the Chemical Society (Resumed). 1875 DOI:10.1039/JR9320001875
- ↑ Zie:
