Organozinkchemie
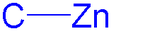
In de organozinkchemie worden verbindingen bestudeerd waarin een directe binding tussen koolstof en zink aanwezig is. Aangezien zink een metaal is, is de organozinkchemie een subdiscipline van de organometaalchemie. Zowel de synthese, de eigenschappen als de toepassingen van dergelijke verbindingen vallen binnen het bereik van de organozinkchemie.[1]
De geschiedenis van de organozinkchemie is de oudste in de organometaalchemie: in 1849 werd di-ethylzink door Edward Frankland ontdekt als eerste verbinding waarin een metaal-koolstofbinding optrad. Veel organozinkverbindingen zijn gevoelig voor oxidatie of zelfs pyrofoor en daardoor lastig te hanteren. De stoffen zijn goed oplosbaar in een grote verscheidenheid aan oplosmiddelen; in protische oplosmiddelen vindt ontleding plaats. In veel gevallen geldt dat in reacties waarin organozinkverbindingen nodig zijn, deze in situ gemaakt worden, niet geïsoleerd maar meteen gebruikt worden. Reacties waarbij organozinkverbindingen worden gebruikt, moeten altijd onder een inerte atmosfeer uitgevoerd worden.
Het meest voorkomende oxidatiegetal is +2. De voornaamste groepen organozinkverbindingen zijn:
- diorganozink R-Zn-R waarin R een alkyl- of arylgroep is.
- organozinkhalogeniden, R-Zn-X waarbij X voor een halogeenatoom staat, en R dezelfde betekenis heeft als hierboven.
- zinkaten M+R3Zn− waarbij het tweede metaal meestal lithium of magnesium is.
De koolstof-zinkbinding is gepolariseerd, met het negatieve einde op koolstof (ENC = 2,55; ENZn = 1,65). Diorganozinkverbindingen zijn altijd monomeer, de organozinkhalogeniden vormen aggregaten die vergelijkbaar zijn met die bij de Grignard-reagentia. De verbindingen zijn ook vergelijkbaar met Grignard-reagentia in het optreden van het Schlenk-evenwicht.
Synthese
[bewerken | brontekst bewerken]Voor de bereiding van organozinkverbindingen is een aantal standaard syntheseroutes bekend:
- Oxidatieve additie. De oorspronkelijke synthese van di-ethylzink door Frankland is een oxidatieve additie van joodethaan aan metallisch zink met waterstof als beschermende inerte atmosfeer. De reactiviteit van het zink kan verhoogd worden door gebruik te maken van Rieke zink, verkregen uit de reductie van zinkchloride met metallisch kalium.
- 2RI + 2Zn → ZnR2 + ZnI2
- Halogeen-Zink-uitwisseling. In deze groep reacties worden zowel de jood-zinkuitwisseling (correct benoemd) als de boor-zinkuitwisseling (eigenlijk niet correct benoemd, boor is geen halogeen) gerangschikt. De eerste stap in de laatste methode is de hydroborering van een alkeen:
- Transmetallatie. In een duidelijk voorbeeld van een transmetallatie wordt difenylkwik met metallisch zink omgezet in difenylzink en kwik(0). Jammer genoeg vraagt deze reactie vrij veel tijd - 2 weken.[2]
- Organozinkverbindingen kunnen rechtstreeks uit het metaal gesynthetiseerd worden:[3]

- Bij dit voorbeeld wordt zink geactiveerd door 1,2-dibroomethaan en trimethylchloorsilaan. Lithiumchloride speelt een sleutelrol: het vormt snel een oplosbaar adduct met de organozinkverbinding. Het metaaloppervlak komt daardoor snel vrij voor een volgende reactie.
Reacties
[bewerken | brontekst bewerken]In veel van hun reacties treden organbozinkverbindigen op als reactief intermediair dat nietzelfstandig geïsoleerd wordt.
- In de Frankland-Duppa-reactie (1863) reageert een oxalaatester (ROCOCOOR) met een alkylhalide R'X, zink en zoutzuur tot de α-hydroxyesters RR'COHCOOR[4]
- Met de Reformatski-reactie kunnen α-halo-esters en aldehyden, via een intermediair organozinkhalide, omgezet worden in β-hydroxy-esters.
- In de Simmons-Smith-reactie reageert het carbenoide joodmethylzinkjodide met alkenen tot cyclopropanen.
- Reacties van zinkacetylides.
- Additiereacties van organozinkverbindingen aan carbonylverbindingen. De Barbier-reactie (1899) is het zinkequivalent van de Grignard reactie en eigenlijk de oudste en de tolerantere van de twee. De aanwezigheid van zelfs maar een spoor water zal de vorming van het organomagnesiumhalide verhinderen, terwijl de Barbier-reactie zelfs in water kan worden uitgevoerd. Elk voordeel heeft echter zijn nadeel: de organozinkverbindingen zijn veel minder nucleofiel dan de overeenkomstige Grignards.
Hoewel een aantal organozinkverbindingen commercieel leverbaar is (dimethylzink, di-ethylzink en difenylzink) worden deze zelden toegepast: de reagentia zijn duur en lastig te hanteren. Zo wordt in een recent (2006) gepubliceerde studie het noodzsakelijke difenylzink gemaakt op basis van broombenzeen, 4 equivalenten n-butyllithium en zinkchloride, een combinatie van standaard laboratoriumreagentia, die per saldo veel goedkoper is.[5]
- De Negishi-koppeling is een belangrijke reactie in het aan elkaar koppelen van onverzadigde koolstofatomen in alkenen, alkynen en aromaten. Als katalysatoren wordt nikkel of palladium gebruikt, maar een sleutelstap in het geheel is de transmetallatie, waarin een organozinkhalide zijn organische groep uitwisselt tegen een halogeen dat aan het palladium (of nikkel) gebonden is. Een vergelijkbare reactie is de Fukuyama-koppeling waarbij een thio-ester tot een keton reageert.
Organozinkaten
[bewerken | brontekst bewerken]Het allereerste organozinkaat werd in 1858 ontdekt door James Alfred Wanklyn,[6] een assistent van Frankland die zich bezighield met de reactie tussen metallisch natrium en di-ethylzink:
- 2Na + 3 Et2Zn → 2Et3Zn−Na+ + Zn
In 2007 werd ontdekt, dat door de reactieomstandigheden iets te wijzigen, het zinkaat werd omgezet in natriumhydridoethylzinkaat(II) (met de watertstofatomen als brugvormend ligand), het gevolg van een beta-hydride eliminatie uit een van de ethylgroepen waarna dimerisatie plaatsvindt:[7]
Organozinc(I)verbindingen
[bewerken | brontekst bewerken]Verbindingen waarin een zink-zinkbinding optreedt zijn ook bekend. Zink heeft twee bindingen waarvan er één geen bijdrage aan de lading levert, zodat zink in dit soort verbindingen eenwaardig is. De eerste verbinding van dit type, Decamethyldizinkoceen, is in 2004 gesynthetiseerd.[8]
Navigatie
[bewerken | brontekst bewerken]Navigatie Koolstof-elementbinding
Externe links
[bewerken | brontekst bewerken]- ↑ Zie o.a.
- P. Knochel, N. Millot, A. Rodriguez, C.E. Tucker. (2001). GEEN TITEL OPGEGEVEN Org. React.. 58 pag.: 417 DOI:10.1002/0471264180.or066.01
- . (1999). GEEN TITEL OPGEGEVEN Ed.: P. Knochel, P. Jones Organozinc reagents - A Practical Approach – Oxford Medical Publications (Oxford) ISBN 0-19-850121-8
- . GEEN TITEL OPGEGEVEN Ed.: W.A. Herrmann Synthetic Methods of Organometallic and Inorganic Chemistry Volume 5, Copper, Silver, Gold, Zinc, Cadmium, and Mercury – ISBN 3-13-103061-5
- ↑ P. Markies, Gerrit Schat, Otto S. Akkerman, F. Bickelhaupt, Anthony L. Spek. (1992). Complexation of diphenylzinc with simple ethers. Crystal structures of the complexes Ph2Zn · glyme and Ph2Zn · diglyme J. Organomet. Chem.. 430 pag.: 1 DOI:10.1016/0022-328X(92)80090-K
- ↑ Arkady Krasovskiy, Vladimir Malakhov, Andrei Gavryushin, Paul Knochel. (2006). Efficient Synthesis of Functionalized Organozinc Compounds by the Direct Insertion of Zinc into Organic Iodides and Bromides Ang. Chem. Int. Ed.. 45 (36): pag.: 6040–6044 DOI:10.1002/anie.200601450
- ↑ Zie o.a.
- E. Frankland. (1863). Formation of α-hydroxycarboxylic esters by reaction of dialkyl oxalates with alkyl halides in the presence of zinc, or amalgamated zinc, and acid Ann.. 126 pag.: 109
- E. Frankland, B. F. Duppa. (1865). GEEN TITEL OPGEGEVEN 135 pag.: 25
- K. Nützel. (1937). GEEN TITEL OPGEGEVEN Ed.: E. Krause, A. von Grosse Die Chemie der metallorganischen Verbindungen pag.: 225 –
- . (1973). GEEN TITEL OPGEGEVEN Houben-Weyl 13/2a pag.: 741 –
- ↑ J.G. Kim, P.J. Walsh. (2006). From Aryl Bromides to Enantioenriched Benzylic Alcohols in a Single Flask: Catalytic Asymmetric Arylation of Aldehydes Ang. Chem. Int. Ed.. 45 (25): pag.: 4175–4178 DOI:10.1002/anie.200600741
- ↑ James Alfred Wanklyn. (1858). Ueber einige neue Aethylverbindungen, welche Alkalimetalle enthalten Liebigs Ann.. 108 (67): pag.: 67–79 DOI:10.1002/jlac.18581080116
- ↑ Anders Lennartson, Mikael Hakansson, Susan Jagner. (2007). Facile Synthesis of Well-Defined Sodium Hydridoalkylzincates(II) Angew. Chem. Int. Ed.. 46 pag.: 6678–6680 DOI:10.1002/anie.200701477
- ↑ S. Schultz. (2010). Low-Valent Organometallics-Synthesis, Reactivity, and Potential Applications Chemistry - A European Journal. 16 (22): pag.: 6416–6428 DOI:10.1002/chem.201000580



