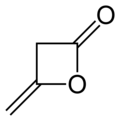
Diketeen
| Diketeen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
Structuurformule van diketeen
| ||||
| Algemeen | ||||
| Molecuulformule | C4H4O2 | |||
| IUPAC-naam | 4-methylideenoxetan-2-on | |||
| Molmassa | 84,08 g/mol | |||
| SMILES | C=C1CC(=O)O1
| |||
| CAS-nummer | 674-82-8 | |||
| EG-nummer | 211-617-1 | |||
| PubChem | 12661 | |||
| Wikidata | Q418541 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H226 - H332 | |||
| EUH-zinnen | geen | |||
| P-zinnen | geen | |||
| EG-Index-nummer | 606-017-00-5 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vloeibaar | |||
| Kleur | kleurloos | |||
| Dichtheid | 1,09 g/cm³ | |||
| Smeltpunt | −7 °C | |||
| Kookpunt | 127 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Diketeen is het dimeer van ethenon oftewel keteen. Diketeen behoort tot de oxetanen. Het is een ontvlambare, kleurloze vloeistof, die bij kamertemperatuur ontstaat door de dimerisatie van keteen en die bij hoge temperatuur terug ontleedt tot keteen. Dit proces is vergelijkbaar met de ontleding van dicyclopentadieen.
Toepassingen[bewerken | brontekst bewerken]
Diketeen wordt gebruikt als bron van keteen in chemische reacties. Het is zelf ook een reactieve stof, die gebruikt wordt bij de synthese van farmaceutische stoffen, insecticiden en kleurstoffen.
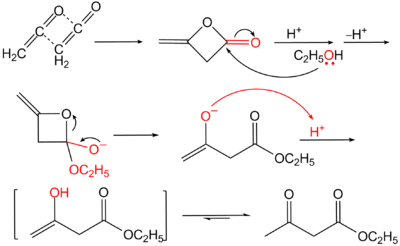
Diketeen reageert gemakkelijk met alcoholen en amines en vormt daarmee derivaten van acetylazijnzuur:
De reactie betreft in eerste instantie een nucleofiele additie van het vrij elektronenpaar van zuurstof (bij alcoholen) of stikstof (bij amines) aan de carbonylgroep, gevolgd door de opening van de ring (door hervorming van de carbonylgroep). De protonering van het ontstane alkoxide leidt via een keto-enoltautomerisatie tot het eindproduct.
Uit diketeen kan ook het vrije acetylazijnzuur bereid worden. Dit kan door het te chloreren met zoutzuur en het resulterende acetoacetylchloride te hydrolyseren met water.[1]
| Bronnen, noten en/of referenties |