Barreleen
| Barreleen | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van barreleen
| ||||

| ||||
Molecuulmodel van barreleen
| ||||
| Algemeen | ||||
| Molecuulformule | C8H8 | |||
| IUPAC-naam | bicyclo[2.2.2]octa-2,5,7-trieen | |||
| Molmassa | 104,14912 g/mol | |||
| SMILES | C1(C=C2)C=CC2C=C1
| |||
| InChI | 1S/C8H8/c1-2-8-5-3-7(1)4-6-8/h1-8H
| |||
| CAS-nummer | 500-24-3 | |||
| PubChem | 136326 | |||
| Wikidata | Q653667 | |||
| ||||
Barreleen is een bicyclische onverzadigde organische verbinding met als brutoformule C8H8. De systematische naam van barreleen is bicyclo[2.2.2]octa-2,5,7-trieen. De molecule bestaat uit 8 CH-eenheden en daarmee is het een valentie-isomeer van cyclo-octatetraeen. De naam is afgeleid van het Engelse woord voor vat (barrel), waarmee de structuurformule een zekere gelijkenis vertoont.
Triptycenen, waarbij de dubbele bindingen van barreleen deel uitmaken van een benzeenring, zijn zowel structureel als in de manier waarop de synthese plaatsvindt, gerelateerde verbindingen. Barreleen is het uitgangspunt voor de synthese van een groot aantal andere verbindingen met complexe moleculaire architectuur, zoals de semibulvalenen.
Structurele eigenschappen en binding
[bewerken | brontekst bewerken]Formeel kan barreleen beschouwd worden als het product van een diels-alderreactie tussen benzeen en ethyn, al verloopt de synthese van barreleen niet langs deze weg. Ten gevolge van de ongebruikelijk starre moleculaire geometrie is barreleen een veel gebruikte modelverbinding in de theoretische chemie. Barreleen beschikt wel over overlappende p-orbitalen, maar het is niet mogelijk de anti-bindende interactie op te heffen. Door dit conflict van p-orbitalen en de overeenkomst daarvan met de Möbiusband wordt deze vorm van binding ook wel aangeduid als Möbiusaromaticiteit. Een groot verschil met de vorming van de π-bindingen in benzeen is dat de orbitaaloverlap slechts optreedt in een helft van de p-orbitaal, waardoor een meer σ-achtige binding ontstaat.
Synthese
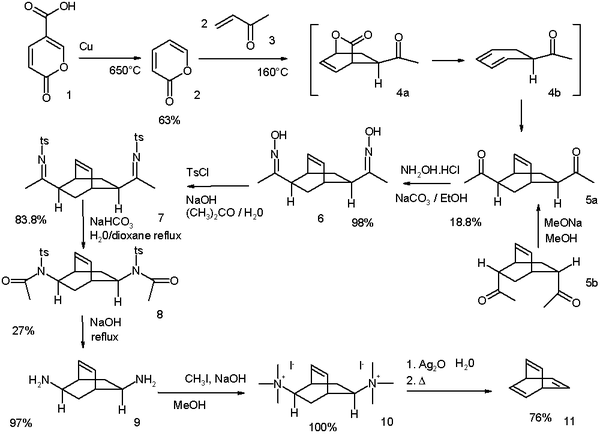
[bewerken | brontekst bewerken]Barreleen werd voor het eerst gesynthetiseerd en beschreven in 1969.[1] De eerste synthese gaat uit van coumalinezuur (1) dat bij 650°C over koper wordt gedecarboxyleerd tot 2-pyron (2). De reactie met twee equivalenten butenon (3) is een dubbele diels-alderreactie en leidt tot een mengsel van 2 isomere diketonen (5a en 5b). Het endo-isomeer (5b) kan in het exo-isomeer (5a) worden omgezet via epimerisatie met behulp van natriummethoxide in methanol. Daarbij treedt een enol op als intermediair. Het diketon wordt met hydroxylamine omgezet in het dioxime (6), waarna met p-tolueensulfonylchloride het overeenkomstig tosylaat gevormd wordt. Via een basisch gekatalyseerde Beckmann-omlegging ontstaat amide 8 en na reactie met natriumhydroxide diamine 9. Dit diamine wordt omgezet in het quaternair ammoniumzout (10), dat een Hofmann-eliminatie ondergaat en waardoor barreleen (11) gevormd wordt.
De opbrengst van deze reactie bedraagt amper 1,94%.
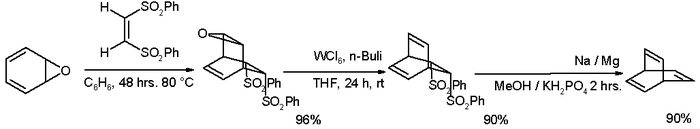
Sindsdien is een groot aantal syntheseroutes naar barreleen beschreven, zoals de onderstaande route die start vanuit oxepine (gepubliceerd in 1997). Het grootste voordeel van deze routes bestaat uit het terugbrengen van het aantal reactiestappen en tegelijkertijd het verhogen van de opbrengst.[2]
Reacties
[bewerken | brontekst bewerken]Additie van H2 en Br2
[bewerken | brontekst bewerken]Barreleen kan gehydrogeneerd worden met waterstofgas en platina(IV)oxide in ethanol tot de volledig verzadigde koolwaterstof bicyclo[2.2.2]octaan. Bromeren met dibroom in tetrachloormethaan levert een dibromide. Homo-allylische stabilisatie en sterische hindering blokkeren verdere reacties:
Epoxidatie
[bewerken | brontekst bewerken]De vorming van een epoxide uit barreleen met kaliumperoxosulfaat geeft het trioxatrishomobarrelaan, dat door omlegging met boortrifluoride (met als drijvende kracht het verlagen van de ringspanning) omgezet wordt in trioxatrishomocubaan.[3] Deze verbinding kan beschouwd worden als een cubaan met in drie zijden een geïnsereerd zuurstofatoom. Een andere manier om naar het molecule te kijken is als een 9-kroon-3-ether, voorzien van een paar extra CH-eenheden. De stof is chiraal en beide enantiomeren zijn geïsoleerd.
Polymerisatie
[bewerken | brontekst bewerken]Sommige barrelenen, zoals benzobarreleen, worden gebruikt als monomeer, waarbij naast de polymerisatie ook een ringopening optreedt.[4] Als katalysator wordt een Fischer-carbeen gebruikt. Oxidatie van het in eerste instantie gevormde polymeer met DDQ levert een naftaleenvariant op van poly(p-fenyleenvinyleen).
- ↑ Howard E. Zimmerman, Gary L. Grunewald, Robert M. Paufler, Maynard A. Sherwin. (1969). Synthesis and physical properties of barrelene, a unique Moebius-like molecule J.Amer.Chem.Soc.. 91 (9): pag.: 2330–2338 DOI:10.1021/ja01037a024
- ↑ Sergio Cossu, Simone Battaggia, and Ottorino De Lucchi. (1997). Barrelene, a New Convenient Synthesis J.Org.Chem.. 62 (12): pag.: 4162–4163 DOI:10.1021/jo962267f
- ↑ Sergei I. Kozhushkov et al.. (2006). 4,7,11-Triheterotrishomocubanes - Propeller-Shaped Highly Symmetrical Chiral Molecules Derived from Barrelene European Journal of Organic Chemistry. 2006 (11): pag.: 2590–2600 DOI:10.1002/ejoc.200600019
- ↑ Lin Pu, Michael W. Wagaman, Robert H. Grubbs. (1996). Synthesis of Poly(1,4-naphthylenevinylenes): Metathesis Polymerization of Benzobarrelenes Macromolecules. 29 (4): pag.: 1138–1143 DOI:10.1021/ma9500143