Dizuurstofdifluoride
| Dizuurstofdifluoride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Structuurformule van dizuurstofdifluoride
| ||||
| Algemeen | ||||
| Molecuulformule | F2O2 | |||
| IUPAC-naam | dizuurstofdifluoride | |||
| Andere namen | fluorperoxide | |||
| Molmassa | 69,995606 g/mol | |||
| SMILES | O(OF)F
| |||
| InChI | 1S/F2O2/c1-3-4-2
| |||
| CAS-nummer | 7783-44-0 | |||
| PubChem | 123257 | |||
| Wikidata | Q420640 | |||
| Vergelijkbaar met | zuurstofdifluoride | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | bruin | |||
| Dichtheid | (bij −57°C) 1,45 g/cm³ | |||
| Smeltpunt | −163,5 °C | |||
| Kookpunt | −57 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Dizuurstofdifluoride is een anorganische verbinding tussen zuurstof en fluor, met als brutoformule O2F2. Bij standaardomstandigheden komt het voor als een bruin gas; in vloeibare vorm is het rood en in vaste vorm oranje.
Synthese[bewerken | brontekst bewerken]
De eerste synthese van de stof werd uitgevoerd door Otto Ruff en Walter Menzel in 1933.[1] Dit gebeurde met behulp van een elektrische ontlading in een gasmengsel van zuurstof en fluor:
De reactie grijpt plaats bij zeer lage temperatuur en druk (−183 °C en 15-20 mm Hg).
Vloeibaar dizuurstofdifluoride wordt gevormd door een zuurstofgas-difluormengsel te verhitten tot 700 °C en dan snel af te koelen op de buitenwand van een roestvrijstalen buis die gekoeld wordt met vloeibare zuurstof.[2]
Dizuurstofdifluoride ontstaat ook door fotosynthese (bestraling van een vloeibaar mengsel van zuurstof en fluor bij −196 °C met ultraviolet licht).[3]
Structuur[bewerken | brontekst bewerken]
In heeft zuurstof het ongebruikelijke oxidatiegetal (+1). In bijna al zijn andere verbindingen heeft dit element oxidatiegetal (-2).
De structuur van dizuurstofdiofluoride lijkt op die van waterstofperoxide, , vooral in zijn grote tweevlakshoek van bijna 90° en de C2-symmetry. Theoretische voorspellingen via VSEPR theory hadden dit al eerder aangegeven.
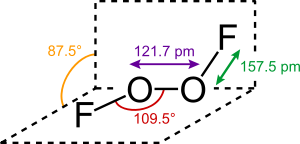
De binding tussern de twee zuurstofatomen is lang een punt van discussie geweest, deze binding is erg kort, nog geen 2 pm langer dan de zuurstof-zuurstof dubbele binding (120,7 pm) in het zuurstofmolecuul naast de relatief grote O−F afstand. Er zijn verschillende voorstellen gedaan om deze verschijnselen te verklaren, waaronder een O−O drievoudige binding, waarbij de enkelvoudige O−F binding gedestabiliseerd wordt, en daardoor langer, door de afstoting tussen de vrij elektronenparen op fluor en de π orbitalen van de O−O band.[4] Afstoting waarbij de vrije elektronenparen van fluor betrokken zijn is ook verantwoordelijk voor de lange en zwakke bindingen tussen de twee fluor-atomen in het fluormolecuul.
In de computationele chemie wordt een ongebruikelijk hoge barrière van 81.17 kJ/mol berekend voor de rotatie om de O-O band. In waterstofperoxide is dit slechts 29.45 kJ/mol, maar het ligt dicht bij de dissociatie van de O−F band: 81.59 kJ/mol.[5]
In het 19F NMR wordt voor een chemische verschuiving gevonden van 865 ppm, veruit de hoogste waarde ooit gevonden voor de chemische verschuiving van een fluor-atoom. Hiermee wordt de onderliggende buitengewone elektronische toestand van deze verbinding nogmaals onderstreept.
Ondanks de instabiliteit van de verbinding zijn veel gegevens over de stof inmiddels verzameld.[6]
Eigenschappen[bewerken | brontekst bewerken]
Dizuurstofdifluoride is instabiel en ontleedt vanaf −95 °C. Het is een sterke oxidator en een fluoreringsmiddel.
Toepassingen[bewerken | brontekst bewerken]
Dizuurstofdifluoride wordt gebruikt als fluoreringsmiddel, bijvoorbeeld om de hexafluoriden van neptunium of plutonium bij lage temperatuur te vormen. Neptunium(VI)fluoride ontstaat door de reactie van dizuurstofdifluoride met neptunium(IV)oxide of neptunium(IV)fluoride:[7]
Dizuurstofdifluoride wordt ook gebruikt om dioxygenylzouten te vormen, die het O2+-ion bevatten, zoals O2BF4 en O2PF6:[8]
Bronnen, noten en/of referenties
|







