Goud(III)bromide
| Goud(III)bromide | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||
Molecuulmodel van goud(III)bromide (dimeer)
| ||||

| ||||
De T-vorm (links) en Y-vorm (rechts) van goud(III)bromide
| ||||
| Algemeen | ||||
| Molecuulformule | AuBr3 | |||
| IUPAC-naam | goud(III)bromide | |||
| Andere namen | goudtribromide | |||
| Molmassa | 436,67855 g/mol | |||
| SMILES | Br[Au](Br)Br
| |||
| InChI | 1S/Au.3BrH/h;3*1H/q+3;;;/p-3
| |||
| CAS-nummer | 10294-28-7 | |||
| EG-nummer | 260-763-2 | |||
| PubChem | 82525 | |||
| Wikidata | Q419635 | |||
| Beschrijving | Donkerrode tot zwarte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H314 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P280 - P305+P351+P338 - P310 | |||
| VN-nummer | 3260 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | donkerrood-zwart | |||
| Smeltpunt | 97,5 °C | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Goud(III)bromide is een anorganische verbinding van goud en broom en heeft als brutoformule AuBr3. Het komt voor als een donkerrode tot zwarte kristallijne vaste stof. Anders dan de brutoformule doet uitschijnen, komt het voornamelijk voor als dimeer: Au2Br6. Dit dimeer hydrolyseert snel in contact met vochtige lucht.
Synthese[bewerken | brontekst bewerken]
Goud(III)bromide wordt bereid door goud te verhitten tot 140°C in een overmaat van vloeibaar dibroom:
Het kan ook bereid worden uit een reactie van goud(III)chloride en waterstofbromide:
Structuur[bewerken | brontekst bewerken]
De structuur van goud(III)bromide is vergelijkbaar met andere driewaardige goudhalogeniden, zoals goud(III)chloride. Toch veroorzaakt het Jahn-Teller-effect één lange en twee korte bindingen tussen goud en broom, terwijl goud(III)chloride twee lange en één korte binding bezit. De verbinding is in evenwicht tussen een zogenaamde T- en Y-vorm.
Eigenschappen[bewerken | brontekst bewerken]
Goud(III)bromide wordt vooral verhandeld als monohydraat (AuBr3·H2O), omdat dit met coördinatiegetal 4 stabieler is dan het anhydraat, dat coördinatiegetal 3 draagt.
Goud(III)bromide is een lewiszuur en kan in waterige oplossingen met waterstofbromide complexen vormen:[1]
Toepassingen[bewerken | brontekst bewerken]
Goud(III)bromide wordt gebruikt als een katalysator. Een voorbeeld vormt de diels-alderreactie met goud(III)bromide:
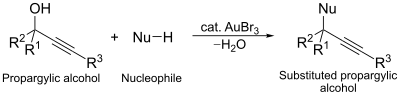
Een tweede voorbeeld is een nucleofiele substitutie op propargylalcohol:
Een oplossing van platina(IV)bromide en goud(III)bromide in water kan worden gebruikt om de aanwezigheid van cesium aan te tonen. Dit kan door een druppel van dit reagens en een druppel van de onbekende oplossing op een filtreerpapiertje te druppelen. Wanneer zich een grijze of zwarte vlek vormt, dan is er cesium aanwezig. Het mechanisme voor deze test is tot op heden onduidelijk.[2]
Externe links[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|