Hogetemperatuurelektrolyse
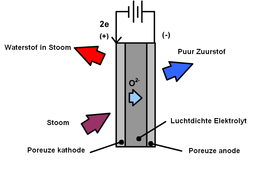
Hogetemperatuurelekrolyse (HTE of stoomelektrolyse) is een methode om uit water waterstof te produceren, met zuurstof als bijproduct. Elektrolyse met hoge temperatuur is efficiënter dan traditionele elektrolyse bij kamertemperatuur, omdat een deel van de energie in de vorm van warmte wordt toegevoegd, wat op een efficiëntere manier kan worden geproduceerd dan elektriciteit, en omdat elektrolyse efficiënter is op hogere temperaturen. Bij een temperatuur van 2500 °C of hoger is elektrische energie overbodig, omdat water bij die temperatuur door middel van thermolyse wordt ontleed in waterstof en zuurstof. Omdat deze temperaturen onpraktisch zijn, opereren voorgestelde HTE-systemen bij temperaturen van 100 tot 850 °C.
De verbetering in efficiëntie komt het beste tot haar recht door aan te nemen dat de gebruikte elektriciteit bij elektrolyse wordt geproduceerd door een warmtemachine. Hierna kan de hoeveelheid benodigde warmte-energie die voor de productie van één kilo waterstof nodig is worden berekend. Hiervoor wordt de benodigde warmte-energie voor het HTE-proces zelf en de hoeveelheid warmte energie die nodig is om de gebruikte elektriciteit op te wekken bij elkaar opgeteld. Op een temperatuur van 100 °C is 350 megajoule aan warmte-energie nodig. Bij deze temperatuur heeft het proces een rendement van 41%. Op een temperatuur van 850 °C is 225 megajoule warmte-energie nodig. Op deze temperatuur is de efficiëntie 64%.
HTE is geen manier om de inefficiëntie van warmtemachines te omzeilen door het geproduceerde waterstof met een brandstofcel om te zetten in elektriciteit; deze verbetering van de efficiëntie zou de theoretische constructie van een perpetuum mobile mogelijk maken, wat onmogelijk is. De economische voordelen van het gebruik van HTE moeten dus worden gezocht in het bevoorraden van chemische processen waar waterstof als grondstof wordt gebruikt, en niet als energiebron. Ook kan deze techniek voordelen hebben voor vervoermiddelen waar waterstof een betere energiedrager is dan elektriciteit, wat nog niet het geval is bij auto's.
HTE kan niet wedijveren met de chemische omzetting van koolwaterstof in waterstof, omdat deze omzettingen niet gehinderd worden door de inefficiëntie van warmtemachines. Mogelijke bronnen van goedkope warmte-energie voor HTE zijn niet-chemische processen, zoals kerncentrales, thermische zonne-energie of aardwarmte.
Als er een goedkope hogetemperatuurbron beschikbaar is, zijn andere methoden om waterstof te produceren mogelijk, zoals de thermochemische cerium(IV)oxide-cerium(III)oxide-cyclus en zwavel-jodiumcyclus. De warmte hiervoor zou geleverd kunnen worden door geconcentreerde zonnewarmte of kernenergie. Thermochemische processen kunnen efficiënter zijn dan HTE, omdat er geen warmtemachine nodig is. Om echter op grote schaal thermochemische processen toe te passen, zijn verbeteringen nodig in materialen die bestand zijn tegen hoge temperaturen, hoge druk en zeer corrosieve omgevingen.
Er wordt momenteel[(sinds) wanneer?] onderzoek gedaan naar zeer hoge temperatuur kernreactoren die water naar waterstof kunnen omzetten in de zwavel-jodiumcyclus. Deze vierde generatie reactoren zijn alleen in het laboratorium getest en worden niet verwacht voor 2030, daarbij is het niet duidelijk of ze in veiligheid en productie kunnen concurreren met het decentrale opwekkingsconcept.
De markt voor waterstof is groot (50 miljoen ton in 2004, met een waarde van $135 miljard per jaar) en groeit elk jaar met ongeveer 10%, zie ook waterstofeconomie. De grootste gebruikers zijn momenteel[(sinds) wanneer?] Olieraffinaderijen en kunstmestfabrieken (zij gebruiken beiden ongeveer de helft van de totale productie). Als waterstofauto's veel gebruikt worden, zal de totale waterstofconsumptie sterk toenemen.
Tijdens een elektrolyse is de hoeveelheid gebruikte energie gelijk aan de som van de verandering in vrije energie en de verliezen in het systeem. In theorie kunnen de verliezen in het systeem nul benaderen, waardoor het maximaal thermodynamische rendement van een elektrochemisch proces 100% kan bereiken. In de praktijk wordt de efficiëntie berekend door de toegevoerde energie te delen door de verandering in vrije energie.
In de meeste gevallen, bijvoorbeeld elektrolyse op kamertemperatuur, is de gebruikte hoeveelheid elektrische energie groter dan de verandering in vrije energie. Dit betekent dat een deel van de toegevoerde energie afgevoerd wordt als overbodige warmte-energie. In sommige gevallen, bijvoorbeeld de elektrolyse van stoom, geldt het tegenovergestelde.
Een solid oxide electrolyser cell (SOEC) is een solid oxide fuel cell in regeneratieve modus voor de elektrolyse van water op temperaturen van 500 tot 850 °C met een vast oxide of keramiek elektrolyt voor de productie van waterstofgas.[1]
Zie ook[bewerken | brontekst bewerken]
Externe link[bewerken | brontekst bewerken]
| Bronnen, noten en/of referenties |
