Natriumthiosulfaat
| Natriumthiosulfaat pentahydraat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
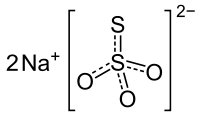
| ||||

| ||||
Kristallen natriumthiosulfaat
| ||||
| Algemeen | ||||
| Molecuulformule | Na2S2O3·5 H2O (pentahydraat) | |||
| IUPAC-naam | natriumthiosulfaat | |||
| Andere namen | natriumhyposulfiet | |||
| Molmassa | watervrij: 158,11 g/mol pentahydraat: 248,18 g/mol | |||
| SMILES | O.[O-]S(=O)(=S)[O-].[Na+].[Na+]
| |||
| InChI | InChI=1/2Na.H2O3S2.H2O/c;;1-5(2,3)4;/h;;(H2,1,2,3,4);1H2/q2*+1;;/p-2/f2Na.O3S2.H2O/q2m;-2;
| |||
| CAS-nummer | 10102-17-7 | |||
| EG-nummer | 231-867-5 | |||
| PubChem | 516922 | |||
| Wikidata | Q339866 | |||
| Beschrijving | witte kristallen | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Hygroscopisch? | ja | |||
| LD50 (ratten) | > 2500[1] mg/kg | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,67[2] g/cm³ | |||
| Smeltpunt | 48[3] °C | |||
| Oplosbaarheid in water | 701[2] g/L | |||
| Goed oplosbaar in | water | |||
| Slecht oplosbaar in | ethanol | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Natriumthiosulfaat of kortweg thio (Na2S2O3) is een kleurloze, bij kamertemperatuur kristallijne stof die meestal als een pentahydraat Na2S2O3.5(H2O) voorkomt.
Bereiding[bewerken | brontekst bewerken]
Natriumthiosulfaat wordt bereid op kleine schaal door toevoegen van zwavel aan een kokende natriumsulfietoplossing :
Toepassingen[bewerken | brontekst bewerken]
Natriumthiosulfaat werd, sinds John Herschel in 1839 deze toepassing ontdekte, als fixeer na het ontwikkelen van fotografische materialen gebruikt.
Natriumthiosulfaat wordt gebruikt om chloor te verwijderen uit oplossingen (en wordt dan ook soms antichlor genoemd):[3]
waarbij ook de ontledingsreactie optreedt:
Dit proces wordt onder meer toegepast na het bleken van papierpulp.
Natriumthiosulfaat kan gebruikt worden:
- bij looien van leer
- in de waterzuivering
- in handwarmers
- om jodiumvlekken uit kleding te halen.
- als antigif voor cyaniden[3]
- in conditioner voor waterbedden[4]
- het aantonen van vitamine c
Analytische chemie[bewerken | brontekst bewerken]
Thiosulfaat wordt veel toegepast als reducerende titrant in de jodometrie. Hierbij wordt dan tetrathionaat gevormd:
Reactie met zuren[bewerken | brontekst bewerken]
Na toevoegen van een sterk zuur (bijvoorbeeld zwavelzuur) wordt het zwakke en instabiele thiozwavelzuur gevormd. Net als koolzuur, hoewel minder snel, ontleedt dit zuur makkelijk:
Het ontstane water verdwijnt in de oplossing. Het gevormde zwaveldioxide is verantwoordelijk voor de prikkelende geur die ontstaat. Het gevormde zwavel is duidelijk waarneembaar, en zorgt ervoor dat de vloeistof troebel wordt.
Bronnen, noten en/of referenties
|





