Diels-alderreactie: verschil tussen versies
Wijzigingen door 130.37.20.27 hersteld tot de laatste versie door Typhoner - geklieder |
k r2.5.2) (robot Erbij: ca:Reacció de Diels-Alder |
||
| Regel 54: | Regel 54: | ||
[[Categorie:Naamreactie]] |
[[Categorie:Naamreactie]] |
||
[[ca:Reacció de Diels-Alder]] |
|||
[[de:Diels-Alder-Reaktion]] |
[[de:Diels-Alder-Reaktion]] |
||
[[en:Diels–Alder reaction]] |
[[en:Diels–Alder reaction]] |
||
Versie van 6 dec 2010 19:00
De Diels-Alder-reactie is een organische reactie (een cycloadditie), waarbij twee moleculen, een geconjugeerd dieen en een gesubstitueerd alkeen, ook wel het diënofiel genoemd, met elkaar reageren tot een gesubstitueerd cyclohexeen. Deze reactie wordt als een van de krachtigste reacties in de organische synthese gezien, gezien deze op betrekkelijk eenvoudige wijze cyclohexeenringen kan produceren, die van nut zijn in verschillende andere organische synthesen.
De reactie is vernoemd naar de Duitse wetenschappers Otto Diels en Kurt Alder, die in 1950 de Nobelprijs kregen voor de ontdekking van de reactie.
Reactiemechanisme
De Diels-Alder-reactie is een concerted reactie; ze vindt plaats in één stap, met slechts één overgangstoestand. Hoge druk of soms verhoogde temperatuur versnellen de reactie. De reactie is een voorbeeld van een pericyclische reactie, meerbepaald een [4+2]-cycloadditie, dit betekent dat er 4 resp. 2 pi-elektronen van de twee reagentia betrokken zijn bij de reactie.
Een schematisch voorbeeld van de Diels-Alder-reactie is de reactie van 1,3-butadieen en etheen. Uit deze reactie ontstaat cyclohexeen.

Het dieen
Het dieen gebruikt in de reactie kan verschillende eigenschappen hebben: zowel cyclisch als een open keten en met allerlei substituenten. De enige voorwaarde is dat het dieen in zogenaamde s-cis-conformatie kan aannemen, waarbij de twee dubbele bindingen aan dezelfde kant van de enkele binding staan. 1,3-butadieen kan bijvoorbeeld vrij roteren rond zijn enkele binding, de s-trans-conformatie waarbij de dubbele bindingen om sterische redenen zo ver mogelijk van elkaar af staan is weliswaar stabieler, maar de energiebarrière voor rotatie is klein genoeg om toch de reactieve s-cis-conformatie aan te kunnen nemen. Cyclische diënen die in een vaste s-cis-configuratie staan zijn om die reden uiterst reactief in Diels-Alder-reacties, met cyclopentadieen als typisch voorbeeld. Cyclische diënen in een vaste s-trans-configuratie kunnen dan weer niet reageren in Diels-Alder-reacties.
Het diënofiel
Het diënofiel beschikt doorgaans over een elektronenzuigende groep (zoals een carbonylgroep) geconjugeerd met het alkeen, of moet met een lewiszuur geactiveerd worden. De eigenschappen van substituenten zullen in hoge mate de regioselectiviteit van de reactie bepalen (zie ook verder).
Hetero-Diels-Alder-reacties
Zowel het dieen als het diënofiel kunnen heteroatomen bevatten, waarbij men het dan heeft over Hetero-Diels-Alder-reacties. Lawessons reagens kan bijvoorbeeld als diënofiel reageren, waarbij een zesring gevormd wordt. Stoffen met stikstof als heteroatoom zoals imines reageren in een zgn. Aza-Diels-Alder-reactie en stoffen met zuurstof zoals carbonylgroepen reageren in een Oxo-Diels-Alder-reactie.
Selectiviteit
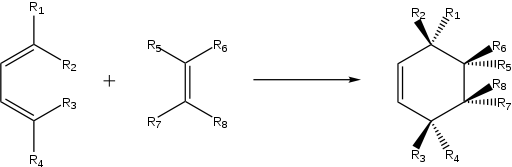
Hoewel er verschillende isomeren gevormd kunnen worden in een Diels-Alder-reactie, zullen enkele ervan in hogere mate - of zelfs alleen - gevormd worden. Doorgaans beschikt het diënofiel over een elektronenzuigende groep, en het dieen over een elektronenstuwende groep, beiden in conjugatie. Aan de hand van resonantie kunnen partiële ladingen toegewezen worden in de respectievelijke reagentia, waardoor men de relatieve oriëntatie van het dieen en diënofiel tijdens de reactie kan voorspellen, en zo ook het welke structuurisomeer gevormd wordt.
Op volgend figuur wordt aangetoond waarom van de gegeven dieen (links) en diënofiel (rechts) slechts één structuurisomeer gevormd wordt (de ortho-variant) en niet de andere mogelijkheid (de meta-variant).

Het cis-principe
Volgens het cis-principe of de Alder-Stein-regels blijft de relatieve stereochemie van de substituenten in de reagentia behouden. Dit betekent dat als een diënofiel twee substituenten heeft die cis staan tegenover elkaar, ze in het reactieproduct nog steeds cis zullen zijn. Hetzelfde geldt voor trans-isomeren van het diënofiel, en ook voor de relatieve configuratie van substituenten van het dieen. Onderstaande reactie toont als voorbeeld dit behoud van configuraties:
De endo-regel
Het cis-principe verklaart hoe de relatieve configuratie van substituenten op het dieen of diënofiel behouden zal blijven, maar niet hoe het dieen en het diënofiel relatief ten opzichte van elkaar zullen terechtkomen. Hoe de relatieve configuratie van de substituenten van de verschillende producten ten opzichte van elkaar zal zijn kan worden voorspeld door de stabiliteit van de overgangstoestanden van de mogelijke reacties te bestuderen. Het blijkt dat de toestand die voorafgaat op het product waarbij de substituenten van het diënofiel in de richting van het de dubbele binding van het eindproduct wijzen doorgaans stabieler is, en dus zal dat product sneller worden gevormd. Het product waarbij substituenten van het diënofiel in de richting van het de dubbele binding wijzen noemt men het endo-product, de andere is het exo-product. Het endo-product wordt dus doorgaans meer gevormd: dit is de endo-regel. De mogelijke benaderingen van een diënofiel in termen van endo- en exo-isomeren worden hieronder aangehaald:

Dit is echter niet altijd waar. Als het exo-product stabieler is dan het endo-product kan men met thermodynamische reactiecontrole (omstandigheden waarbij het meest stabiele product met meest gevormd wordt, en niet het product dat het snelst kan gevormd worden) meer van het exo-product verkrijgen. De omgekeerde reactie, waarbij uit een cyclohexeen een diëen en een alkeen ontstaan, wordt een retro-Diels-Alder-reactie genoemd. Onderstaande afbeelding toont de regel: het endo-product (links) wordt doorgaans sneller en meer gevormd dan het exo-product (rechts).

Toepassingen
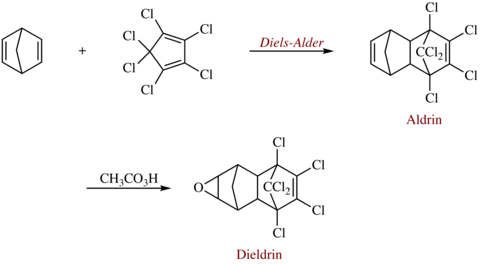
Diels-Alder-reacties worden gebruikt in de synthese van verschillende chemische producten. Een interessant voorbeeld zijn de gechloreerde insecticiden aldrin en dieldrin, genoemd naar de ontdekkers van de reactie. Aldrin wordt gevormd door hexachloorcyclopentadieen met norbornadieen in een Diels-Alder-reactie met elkaar te laten reageren. Een epoxidatie van de norborneenring vormt hieruit dan dieldrin.
Ook het insecticide en acaricide endosulfan en de chemische grondstof anthrachinon worden o.a. met een Diels-Alder-reactie gesynthetiseerd.