Gebruiker:T.vanschaik/Kladblok
| Zirkonoceendichloride | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||

| ||||

| ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Molmassa | 292,31 g/mol | |||
| SMILES | [cH-]1cccc1.[cH-]1cccc1.[Cl-].[Cl-].[Zr+4]
| |||
| InChI | 1/2C5H5.2ClH.Zr/c2*1-2-4-5-3-1;;;/h2*1-5H;2*1H;/q2*-1;;;+4/p-2
| |||
| CAS-nummer | 1291-32-3 | |||
| PubChem | 10891641 | |||
| Beschrijving | Vaste, witte stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| [1] | ||||
| Oplosbaarheid in water | Hydrolyseert | |||
| ||||
Zirkonoceendichloride is een organozirkoniumverbinding met zirkonium als centraal atoom. Verder zijn er twee cyclopentadiënyl en twee chloorliganden. De formule kan geschreven worden als , en met meer nadruk op de structuur als ,[Noot 1] wat in artikelen over de metallocenen, met Cp voor de cyclopentadiëen-ring, meestal genoteerd wordt als . Het is een kleurloze, diamagnetische vaste stof, die slechts matig stabiel is in de lucht.
Synthese[bewerken | brontekst bewerken]
Zirkonoceendichloride kan verkregen worden uit de reactie van het zirkonium(IV)chloride-THF-complex met cyclopentadiënylnatrium
De nauw verwante verbinding werd voor het eerst in 1954 beschreven.[2]
Structuur[bewerken | brontekst bewerken]
De verbinding is een gebogen metalloceen: de twee Cp-ringen liggen niet parallel aan elkaar. De gemiddelde hoek tussen het centrum van de Cp-ringen en het zirkonium-atooom is 128°. De Cl-ZrCl-hoek is 97.1°, wat meer is dan in nioboceendichloride (85.6°) en molybdoceendichloride (82°) de twee volgende elementen in de periode van Zr. De trend die hier optreedt heeft geholpen bij het bepalen van de oriëntatie van de |HOMO in deze groep complexen.[3]
Reacties[bewerken | brontekst bewerken]
Met zirkonoceendichloride als basis zijn meerdere reagentia ontwikkeld. Deze stoffen zijn vernoemd naar de onderzoekers die ze ontdekt hebben.
Schwartz's reagens[bewerken | brontekst bewerken]
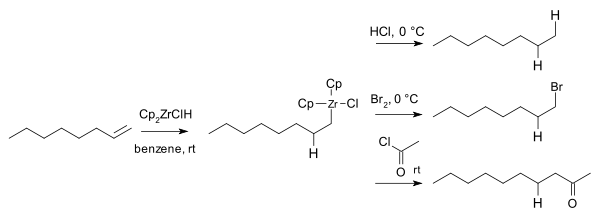
Zirconoceendichloride reageert met lithiumaluminiumhydryde onder vorming van , wat bekend staat als het Schwart's reagens]]:
Dit reagens kan ingezet worden voor additie's aan alkenen en alkynen.[4]
Negishi reagens[bewerken | brontekst bewerken]
Zirkonoceendichloride kan ook gebruikt worden om het Negishi-reagens te maken, dat als bron van gebruikt kan worden. Hierbij wordt behandeld met n-butyllithium, waarbij de twee chloride=liganden vervangen worden door twee butylgroepen. De dibutylverbinding ondergaat β-hydride-eliminatie, waarbij een η2-buteenligand ontstaat. Het gevormde butaan komt daarbij vrij.[5]

Carboaluminering[bewerken | brontekst bewerken]
Zirkonoceendichloride katalyseert de carboaluminering van alkynen door trimethylaluminium waarbij alkenyldimethylalanen gevormd worden. Deze vormen op hun beurt de basis voor drievoudig gesubstitueerde akenen. Zo kan het α-E,E-farneseen (één van de vier isomeren) zuiver bereid worden in een opbrengst van bijna 70% over-all in de reactie van 1-buten-3-yn]] met trimethylaluminium, gevolgd door de palladium gekatalyseerde reactie van het product met geranylchloride.[6]

Met trimethylaluminium in deze reactie wordt alleen het syn-additieproduct gevormd en met eindstandige alkynen wordt met een hoge selectiviteit (in het algemeen > 10:1) het anti-Markovnikovproduct gevormd. Jammer genoeg worden met hogere alkylaluminium-verbindingen slechtere resulaten geboekt (door β-hydride-eliminatie van het alkylzirkonium intermediair).[7] Practische toepassingen va deze reactie zijn dus beperkt al geldt aan de andere kant dat een methyl-gesubstitueerde dubbele binding een veel voorkomend motief is in natuurstoffen.
Zr-walk[bewerken | brontekst bewerken]
Zirconocene dichloride together with a reducing reagent can form the zirconocene hydride catalyst in situ, which allows a positional isomerization (so-called "Zr-walk"[8]), and ends up with a cleavage of allylic bonds. Not only individual steps under stoichiometric conditions were described with Schwartz reagent,[9] and Negishi reagent,[10] but also catalytic applications on alkene hydroaluminations,[11] radical cyclisation,[12] polybutadiene cleavage,[13] and reductive removal of functional groups[14] were reported.

| Bronnen, noten en/of referenties
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Zirconocene dichloride op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Algemene achtergrond
Ńoten in de tekst
Verwijzingen in de tekst
|










