Kwik(II)thiocyanaat
| Kwik(II)thiocyanaat | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
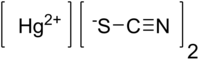
Structuurformule van kwik(II)thiocyanaat
| |||||
| Algemeen | |||||
| Molecuulformule | Hg(SCN)2 | ||||
| IUPAC-naam | kwik(II)thiocyanaat | ||||
| Andere namen | kwikdithiocyanaat | ||||
| Molmassa | 316,7548 g/mol | ||||
| SMILES | C(#N)[S-].C(#N)[S-].[Hg+2]
| ||||
| InChI | 1S/2CHNS.Hg/c2*2-1-3;/h2*3H;/q;;+2/p-2
| ||||
| CAS-nummer | 592-85-8 | ||||
| EG-nummer | 209-773-0 | ||||
| PubChem | 11615 | ||||
| Wikidata | Q416035 | ||||
| Beschrijving | Witte kristallen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H330 - H310 - H300 - H373 - H400 - H410 | ||||
| EUH-zinnen | EUH032 | ||||
| P-zinnen | P273 - P280 - P304+P340-P302+P352-P309+P311 | ||||
| Opslag | Gescheiden van sterke zuren. | ||||
| VN-nummer | 1646 | ||||
| MAC-waarde | 0,1 mg/m³ | ||||
| LD50 (ratten) | (oraal) 46 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 3,71 g/cm³ | ||||
| Oplosbaarheid in water | (bij 20°C) 0,63 g/L | ||||
| Goed oplosbaar in | zoutzuur | ||||
| Slecht oplosbaar in | water | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | monoklien | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Kwik(II)thiocyanaat is het kwikzout van thiocyaanzuur en heeft als brutoformule Hg(SCN)2. De stof komt voor als witte monokliene kristallen, die zeer slecht oplosbaar zijn in water.
Synthese[bewerken | brontekst bewerken]
Kwik(II)thiocyanaat wordt bereid door de reactie van een oplosbaar kwik(II)zout (zoals kwik(II)chloride) met een thiocyanaat-zout (zoals kaliumthiocyanaat) in waterige oplossing. Het witte kwik(II)thiocyanaat vormt dan een neerslag:
Toepassingen[bewerken | brontekst bewerken]
Kwik(II)thiocyanaat werd vroeger gebruikt in de pyrotechniek om een zogenaamde faraoslang te maken. Dit is een lange, slangvormige constructie die voornamelijk uit as bestaat en ontstaat door de verbranding van kwik(II)thiocyanaat, in combinatie met wat glucose als extra brandstof. Dit wordt niet meer gedaan, gezien de hoge toxiciteit van kwik en diens verbindingen.
Tegenwoordig wordt het gebruikt als indicator voor chloride-ionen bij kwalitatieve analyses en in de fotografie bij het ontwikkelen en versterken van negatieven.




