One-pot-reactie
In de chemie is een one-pot-reactie een methode om de opbrengst van een chemische reactie te verhogen. Het woord wordt doorgaans onvertaald uit het Engels overgenomen. Tijdens de reactie wordt het uitgangsmateriaal van de synthese steeds in hetzelfde reactievat (bijvoorbeeld een rondbodemkolf) aan een opeenvolging van reactanten blootgesteld. Voor chemici heeft dit het voordeel dat het vaak langdurige proces van scheiding en zuivering van de tussenproducten vermeden kan worden. Naast de tijdwinst betekent dit ook vaak winst in opbrengst, omdat bij scheiding en zuivering ook verliezen optreden.
De grenzen van een one-pot-reactie worden bereikt als tussenproducten en uitgangsstoffen chemisch te veel op elkaar lijken. Wordt het tweede reagens toegevoegd, voordat alle uitgangsstof is omgezet in het eerste tussenproduct, dan kunnen zowel het tussenproduct in een gewenste reactie, als de oorspronkelijke uitgangsstof in een niet bedoelde reactie reageren. In dat geval ontstaan verbindingen die erg op elkaar lijken en dus heel moeilijk van elkaar te scheiden zijn.
Een sequentiële one-pot-reactie waarbij de reagentia een voor één, na elkaar en zonder opwerken in de reactor gebracht worden, wordt ook wel aangeduid met een telescoopsynthese. Er wordt als het ware steeds een nieuwe verlengstuk aan de synthese toegevoegd.
Voorbeelden[bewerken | brontekst bewerken]
Voorbeelden van one-pot-reacties zijn:
- de totaalsynthese van tropinon
- de Gassman-indoolsynthese
- een van de synthesen van oseltamivir, waarbij opeenvolgende one-pot-reacties gebruikt worden om vanuit relatief eenvoudige moleculen een molecuul op te bouwen met meerdere chirale centra[1]
Het aantal chemische handelingen wordt aanzienlijk verminderd, waardoor deze benadering ook een belangrijk commercieel aspect heeft.
Een uitgewerkt voorbeeld van een one-pot-reactie (de synthese van 7-hydroxychinoline) staat in onderstaand schema weergegeven.[2] De reactie van 3-N-tosylaminofenol (I) met acroleïne (II) levert een hydroxylderivaat van chinoline (III) op. Via vier opeenvolgende stappen zonder tussentijds opwerken van de intermediairen:
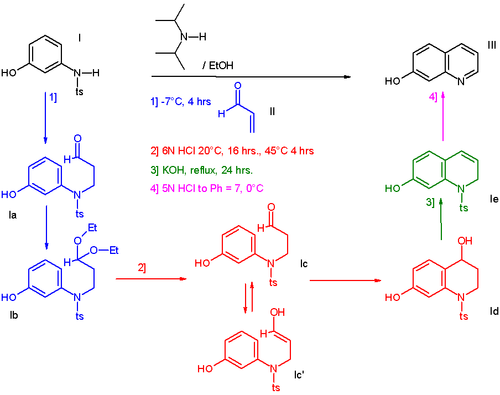
De reactie tussen 3-N-tosylaminofenol en acroleïne is een Michael-additie, gekatalyseerd door N,N-di-isopropylamine. Onder invloed van deze base wordt het aldehyde met het oplosmiddel ethanol omgezet in een acetaal (Ib), dat vervolgens door het toegevoegde zoutzuur weer overgaat in het vrije aldehyde. Het enolaat reageert dan als elektrofiel in een Friedel-Craftsalkylering, waarbij ook ringsluiting optreedt. De alcoholfunctie uit structuur Id wordt geëlimineerd met behulp van kaliumhydroxide (Ie). Als in de laatste stap het reactiemengsel geneutraliseerd wordt tot pH 7, gaat ook de tosylgroep verloren en blijft het 7-hydroxychinoline over.
Bronnen, noten en/of referenties
|
